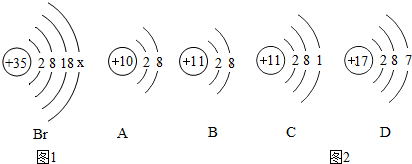
题目内容
4. 如图所示的照片拍摄于某处天然温泉,请回答下列问题:
如图所示的照片拍摄于某处天然温泉,请回答下列问题:(1)温泉水中有很多矿物质(例如硫酸钠),硫酸钠的溶解
度表如下所示.要将其从温泉水中提取出来通常采用的方
法是蒸发结晶.
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
| 溶解度/g | 4.9 | 9.1 | 19.5 | 40.8 | 48.8 | 47.6 | 45.3 | 45 | 43.7 | 42.7 |
(3)10℃时,在100g水中加入47g Na2SO4固体,充分溶解后,加热到60℃.加热前后,有关溶液的说法正确的是A、D、F(填字母序号).
A.10℃时,溶液中溶质的质量分数为8.3%
B.10℃时和60℃时,溶液中溶质的质量分数相同
C.加热过程中,60℃时溶液中溶质的质量分数最大
D.加热过程中,溶液中溶剂的质量始终不变
E.10℃升至60℃,Na2SO4的溶解度逐渐增大
F.加热过程中,Na2SO4溶液由饱和溶液变成不饱和溶液,最终又变成饱和溶液
(4)向硫酸钠溶液中加入氯化钡溶液,产生白色沉淀,已知该反应属于复分解反应.请写出该反应的化学方程式:Na2SO4+BaCl2=BaSO4↓+2NaCl.
分析 (1)根据硫酸钠的溶解度随温度的变化情况来分析;
(2)根据硬水与软水的概念来分析;
(3)根据硫酸钠在不同温度的溶解度以及其溶解度受温度的影响来分析;
(4)根据化学反应的原理以及化学方程式的写法来分析.
解答 解:(1)由表格数据可知,0℃-40℃时,硫酸钠的溶解度随着温度的升高而增大,但是40℃后随着温度的升高,硫酸钠的溶解度反而减小,所以对这种物质只能采用蒸发结晶的方法来提取;故填:蒸发结晶;
(2)温泉水中含有较多的可溶性钙离子、和镁离子,所以该温泉水属于硬水;故填:硬水;
(3)A.10℃时,硫酸钠的溶解度为9.1g,所以10℃时,在100g水中加入47g Na2SO4固体只能溶解9.1g,所以所得溶液中溶质的质量分数为$\frac{9.1g}{9.1g+100g}×100%$≈8.3%,故正确;
B.10℃时,硫酸钠的溶解度为9.1g;60℃时,硫酸钠的溶解度为45.3g,所以在100g水中所溶解的硫酸钠的质量不同,因此溶质的质量分数也不相同,故错误;
C.由溶解度数据可知,40℃和50℃时,硫酸钠的溶解度均大于47g,而60℃时,硫酸钠的溶解度减小为45.3g,所以加热过程中,40℃和50℃时溶质的质量分数相同,溶液中溶质的质量分数最大,故错误;
D.加热过程中,溶液中溶剂的质量始终不变,仍为100g,故正确;
E.10℃升至60℃,Na2SO4的溶解度先变大,后变小,故错误;
F.由表格数据可知,0℃-40℃时,硫酸钠的溶解度随着温度的升高而增大,但是40℃后随着温度的升高,硫酸钠的溶解度反而减小,小到47g以下,因此加热过程中,Na2SO4溶液由饱和溶液变成不饱和溶液,最终又变成饱和溶液,故正确;
故填:A、D、F;
(4)硫酸钠与氯化钡发生复分解反应生成硫酸钡白色沉淀和氯化钠,故填:Na2SO4+BaCl2=BaSO4↓+2NaCl.
点评 本题考查了结晶方法、硬水与软水的判断、溶解度等的有关知识,完成此题,可以依据已有的知识结合题干提供的信息进行.

 天天练口算系列答案
天天练口算系列答案| 选项 | 物质 | 杂质 | 除杂质的方法 |
| A | K2CO3溶液 | KCl | 加入适量的稀盐酸 |
| B | Fe | Zn | 加入足量的FeSO4溶液,充分反应,过滤,烘干 |
| C | NaOH溶液 | Na2CO3 | 加入足量的BaCl2溶液,充分反应,过滤 |
| D | H2 | HCl | 将气体通过盛浓硫酸的洗气瓶 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 单质 | B. | 原子 | C. | 元素 | D. | 分子 |
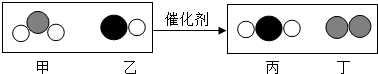
| A. | 乙物质由两个元素组成. | |
| B. | 甲和丁中同种元素化合价不相等 | |
| C. | 该反应中涉及到的最小微粒是分子 | |
| D. | 化学方程式中乙、丁的物质的量之比为1:1 |
 如图是电解水的微观模型图,从中获得的信息不正确的是( )
如图是电解水的微观模型图,从中获得的信息不正确的是( )| A. | 在化学反应中,分子可以再分,原子不能再分 | |
| B. | 每个水分子由2个氢原子和1个氧原子构成 | |
| C. | 水分解过程中,原子的种类、分子的种类都不变 | |
| D. | 在化学反应中,元素的种类和质量都不改变 |
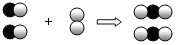 如图是用来表示物质间发生化学变化的模型示意图,图中“
如图是用来表示物质间发生化学变化的模型示意图,图中“ 、
、 ”分别表示两种不同元素的原子,能用该示意图表示的化学反应是( )
”分别表示两种不同元素的原子,能用该示意图表示的化学反应是( )| A. | 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O | B. | CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O | ||
| C. | 2CO+O2 $\frac{\underline{\;点燃\;}}{\;}$2CO2 | D. | 2Na+Cl2$\frac{\underline{\;点燃\;}}{\;}$2NaCl |
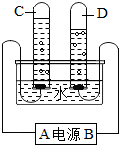 人类的日常生活和工农业生产都离不开水.请回答下列与水有关的问题:
人类的日常生活和工农业生产都离不开水.请回答下列与水有关的问题: