题目内容
4.用化学用语填空:2个氮气分子2N2甲烷CH4氢氧化铁Fe(OH)3.
分析 分子的表示方法,正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字.
由常见有机物的化学式进行书写即可.
氢氧化铁中铁元素显+3价,氢氧根显-1价,写出其化学式即可.
解答 解:由分子的表示方法,正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字,则2个氮气分子可表示为:2N2.
甲烷的化学式为:CH4.
氢氧化铁中铁元素显+3价,氢氧根显-1价,其化学式为:Fe(OH)3.
故答案为:2N2;CH4;Fe(OH)3.
点评 本题难度不大,掌握常见化学用语(分子符号、化学式等)的书写方法是正确解答此类题的关键.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
12.实验开放日,某化学兴趣小组在学校实验室进行酸和碱的化学性质探究实验,邀你一同参加.
(1)探究稀硫酸与氢氧化钠是否发生化学反应
化学实验常伴随明显的实验现象,但稀硫酸与氢氧化钠溶液反应无明显现象,化学兴趣小组经过讨论,按图示操作进行实验:

当滴入几滴酚酞试液后,溶液由无色变为红色,根据上述实验中颜色变 化,可确定稀硫酸与氢氧化钠溶液发生了化学变化,反应的化学方程式 为2NaOH+H2SO4=Na2SO4+2H2O.
(2)探究上述稀硫酸与氢氧化钠溶液反应后烧杯中的硫酸是否过量
根据上述反应过程中溶液变成无色,不能确定稀硫酸是否过量,同学们又分别选取氯化钡溶液、紫色石蕊试液设计实验方案,请你判断并分析:
上述设计的实验方案中,正确的是方案二(填“方案一”或“方案二”).
另外一个实验方案错误的原因是NaOH和H2SO4反应后生成的硫酸钠也能和BaCl2反应产生白色沉淀BaSO4.
请你设计一个确定稀硫酸是否过量的实验方案,你选用的药品是锌粒(或碳酸钠等),实 验现象及结论是若有气体放出,证明稀硫酸过量,反之稀硫酸不过量.
(1)探究稀硫酸与氢氧化钠是否发生化学反应
化学实验常伴随明显的实验现象,但稀硫酸与氢氧化钠溶液反应无明显现象,化学兴趣小组经过讨论,按图示操作进行实验:

当滴入几滴酚酞试液后,溶液由无色变为红色,根据上述实验中颜色变 化,可确定稀硫酸与氢氧化钠溶液发生了化学变化,反应的化学方程式 为2NaOH+H2SO4=Na2SO4+2H2O.
(2)探究上述稀硫酸与氢氧化钠溶液反应后烧杯中的硫酸是否过量
根据上述反应过程中溶液变成无色,不能确定稀硫酸是否过量,同学们又分别选取氯化钡溶液、紫色石蕊试液设计实验方案,请你判断并分析:
| 实验方案 | 实验步骤 | 实验现象 | 实验结论 |
| 方案一 | 取样,滴入适量的氯化钡溶液 | 出现白色沉淀 | 稀硫酸过量 |
| 方案二 | 取样,滴入几滴紫色石蕊试液 | 溶液变红 | 稀硫酸过量 |
另外一个实验方案错误的原因是NaOH和H2SO4反应后生成的硫酸钠也能和BaCl2反应产生白色沉淀BaSO4.
请你设计一个确定稀硫酸是否过量的实验方案,你选用的药品是锌粒(或碳酸钠等),实 验现象及结论是若有气体放出,证明稀硫酸过量,反之稀硫酸不过量.
19.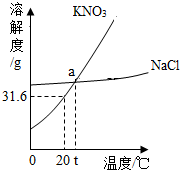 如图是KNO3和NaCl的溶解度曲线,以下说法不正确的是( )
如图是KNO3和NaCl的溶解度曲线,以下说法不正确的是( )
 如图是KNO3和NaCl的溶解度曲线,以下说法不正确的是( )
如图是KNO3和NaCl的溶解度曲线,以下说法不正确的是( )| A. | a点表示的含义:t℃,KNO3和NaCl的溶解度相等 | |
| B. | KNO3饱和溶液中含有少量的NaCl,可采用降温结晶法提纯KNO3 | |
| C. | 20℃,向50 g水中加入16 g KNO3,可得到66 g KNO3溶液 | |
| D. | 将t℃时两种物质的饱和溶液降温到20℃,所得溶液的质量分数NaCl大于KNO3 |
9.以下自然资源的利用过程中,发生了化学变化的是( )
| A. | 海水晒盐 | B. | 风力发电 | C. | 煤的干馏 | D. | 石油分馏 |
16.下列物质能在pH=1的溶液中共存且形成无色溶液的是( )
| A. | (NH4)2SO4、NaNO3、KCl | B. | K2SO4、KNO3、KMnO4 | ||
| C. | Na2SO4、NaCl、Na2CO3 | D. | BaCl2、NaNO3、K2SO4 |
13.小明家有包开启了的小苏打,久置在灶台上方,可能因受热而变质.小明为此开展了探究,请分析其过程完成填空.
【查阅资料】①2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O
②2NaHCO3+Ca(OH)2=CaCO3↓+Na2CO3+2H2O
③Na2CO3受热不分解,NaHCO3能溶与水.
【假设猜想】假设一:小苏打没有变质,化学成分为NaHCO3;
假设二:小苏打完全变质,化学成分为Na2CO3;
假设三:小苏打部分变质,化学成分为NaHCO3和Na2CO3.
【实验方案】(实验现象)
可选药品:①Ca(OH)2溶液 ②CaCl2溶液 ③NaOH溶液 ④稀盐酸
【问题讨论】有同学认为,取一定量样品直接加热,再将产生的气体通入澄清石灰水,根据实验现象,对上述三种假设的每一种是否成立都能进行判断.请评价这种方案是否合理否(填“是”或“否”),理由是不能判断是不变质还是部分变质的情况.
【查阅资料】①2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O
②2NaHCO3+Ca(OH)2=CaCO3↓+Na2CO3+2H2O
③Na2CO3受热不分解,NaHCO3能溶与水.
【假设猜想】假设一:小苏打没有变质,化学成分为NaHCO3;
假设二:小苏打完全变质,化学成分为Na2CO3;
假设三:小苏打部分变质,化学成分为NaHCO3和Na2CO3.
【实验方案】(实验现象)
可选药品:①Ca(OH)2溶液 ②CaCl2溶液 ③NaOH溶液 ④稀盐酸
| 实验操作 | 实验现象 | 实验结论 |
| 操作一:取小苏打样品少量溶于足量水后,加入过量的②(填药品编号,下同),观察,如有沉淀,则继续进行下一步操作. 操作二:待操作一中反应充分后过滤,并在滤液中加入过量的④,观察. | 操作一中无沉淀出现[来 | 假设一成立[] |
| 操作一中有沉淀出现 操作二中无气体产生 | 假设二成立 | |
| 操作一中有沉淀出现 操作二中有气体产生 | 假设三成立 |
 化学学习小组在实验室里加热高锰酸钾制取氧气,反应过程中测得剩余固体质量与加热时间的关系如图所示.
化学学习小组在实验室里加热高锰酸钾制取氧气,反应过程中测得剩余固体质量与加热时间的关系如图所示.