题目内容
4.称取银、锌混合物粉末共15g置于烧杯中,慢慢加入足量的稀硫酸使其充分反应,直到固体质量不在减少为止,剩余固体5.25g.(1)求混合物粉末中银、锌的质量分数?
(2)计算反应后生成了氢气的质量?
分析 根据金属活动性可知,金属银不能与稀硫酸发生反应,而锌与稀硫酸放出氢气;固体质量不再减少,可判断锌已完全反应,反剩余固体为不能反应的银;混合物粉末的质量与银的质量差即反应所消耗锌的质量,利用该质量计算出反应生成的氢气的质量.
解答 解:(1)该混合物粉末中银的质量分数=$\frac{5.25g}{15g}$×100%=35%;
混合物中锌的质量分数为:1-35%=65%;
(2)混合物中金属锌的质量=15g-5.25g=9.75g
设生成氢气的质量为的质量为x
Zn+H2SO4=ZnSO4+H2↑
65 2
9.75g x
$\frac{65}{2}=\frac{9.75g}{x}$
x=0.3g
答:(1)该混合物粉末中银的质量分数是35%,锌的质量分数为65%;
(2)生成氢气的质量为0.3g.
点评 根据金属的活动性,分析题中所发生的反应,判断出所余固体为银,此为本题的突破口.

练习册系列答案
相关题目
19. 火山灰中含有高浓度的氟,会对人类和其他生物的健康造成很大影响.元素周期表中氟元素的相关信息如图,下列说法正确的是( )
火山灰中含有高浓度的氟,会对人类和其他生物的健康造成很大影响.元素周期表中氟元素的相关信息如图,下列说法正确的是( )
 火山灰中含有高浓度的氟,会对人类和其他生物的健康造成很大影响.元素周期表中氟元素的相关信息如图,下列说法正确的是( )
火山灰中含有高浓度的氟,会对人类和其他生物的健康造成很大影响.元素周期表中氟元素的相关信息如图,下列说法正确的是( )| A. | 氟原子的核外电子数为19 | B. | 氟属于金属元素 | ||
| C. | 氟原子的中子数为9 | D. | 氟原子的质子数为9 |
9.“速力菲”是治疗缺铁性贫血的药物,主要成分是琥珀酸亚铁(C4H4O4Fe),下列说法正确的是( )
| A. | 琥珀酸亚铁由4个C原子、4H个原子、4个O原子、1个Fe原子构成 | |
| B. | 琥珀酸亚铁由4种元素组成 | |
| C. | 琥珀酸亚铁中C、O两种元素的质量比为1:1 | |
| D. | 琥珀酸亚铁的相对分子质量为172g |
16.20℃时,将等质量的a、b两种不含结晶水的固体物质,分别加入到盛有100g水的烧杯中,充分搅拌后,现象如图1;然后升温到50℃时,现象如图2;a、b两种物质的溶解度曲线如图3.由这一过程可知( )
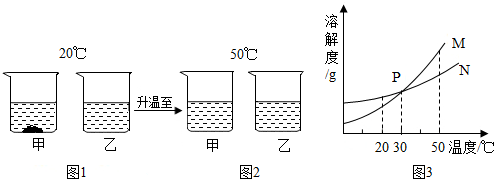

| A. | 图1中甲溶液溶质质量分数比乙溶液大 | |
| B. | 图2中甲、乙溶液一定都是饱和溶液 | |
| C. | 图3中表示甲的溶解度曲线是M | |
| D. | 30℃时,甲、乙溶液溶质质量分数不相等 |
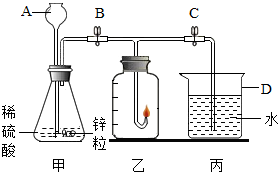 某化学兴趣小组的同学准备用氢气燃烧法测定空气中氧气的体积分数,设计的实验装置如图:
某化学兴趣小组的同学准备用氢气燃烧法测定空气中氧气的体积分数,设计的实验装置如图:



