题目内容
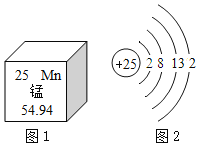
【题目】元素周期表中部分元素的原子结构示意图如图所示,请根据表中信息回答下列问题。

(1)氧原子的质子数为____,画出S2﹣的结构示意图___。
(2)同周期元素性质变化规律:从左到右,金属性逐渐减弱,非金属性逐渐增强,原子的半径逐渐减小。第三周期中金属性最强的元素是___(填元素符号),S、Cl中半径较小的是___。
(3)元素的化学性质主要由最外层电子数决定。碳与硅的最外层电子数___,所以它们有相似的化学性质。已知CO2+2NaOH═Na2CO3+H2O,写出SiO2与NaOH溶液反应的化学方程式:___。
【答案】8  Na Cl 相同 SiO2+2NaOH=Na2SiO3+H2O
Na Cl 相同 SiO2+2NaOH=Na2SiO3+H2O
【解析】
(1)由原子结构示意图可知,氧原子的质子数为8;硫原子的质子数为16,最外层有6个电子,在化学反应中硫原子易得到2个电子而形成硫离子,S2﹣的结构示意图: ;
;
(2)同周期元素性质变化规律:从左到右,金属性逐渐减弱,非金属性逐渐增强,原子的半径逐渐减小。第三周期中金属性最强的元素是钠;S、Cl中半径较小的是Cl;
(3)元素的化学性质主要由最外层电子数决定。碳与硅的最外层电子数相同,所以它们有相似的化学性质。已知CO2+2NaOH═Na2CO3+H2O,则SiO2与NaOH反应生成硅酸钠和水:SiO2+2NaOH=Na2SiO3+H2O;

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目