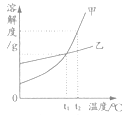
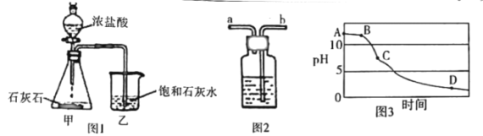
��Ŀ����
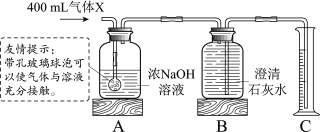
����Ŀ��A��B��C��D��E��F��Ϊ�������ʣ����ǵ�ȫ����Ӧ��ת����ϵ��ͼ��ʾ��ͼ���á�һ����ʾ���������ܷ�����Ӧ���á�������ʾ�������ʼ���ת�������ַ�Ӧ��������P��Ӧ��������ȥ��ͼ�в��ַ�Ӧ������Һ�н��У���������Һ��ֻ�������ʣ���������2�����3���Σ�DΪֲ�������õ�����ԭ�ϣ�E���ڲ�����ϴ�Ӽ���������FΪһ���ᣬ��ش��������⣺
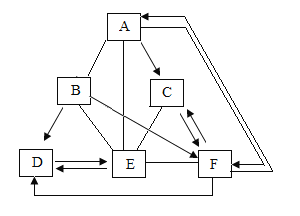
��1����ѧʽD_____��F_____��
��2��д��A��C�Ļ�ѧ����ʽ_____��
��3������B�����E��Ӧ��ʵ��������_____��
���𰸡�CO2 HNO3 ![]() ��ɫ�������������ݣ�����Һ�в������ݣ���������������ʧ
��ɫ�������������ݣ�����Һ�в������ݣ���������������ʧ
��������
DΪֲ�������õ�����ԭ�ϣ�D�Ƕ�����̼���壬������̼�ܲ��ڹ�����ã�E���ڲ�����ϴ�Ӽ��������������������̼�ת������E��̼���ƣ�������̼���������Ʒ�Ӧ����̼���ƣ�̼������ϡ���ᷴӦ�ܲ���������̼��F��һ���ᣬ����̼���Ʒ�Ӧ��B����̼���Ʒ�Ӧ��ͬʱ�ܲ���������̼���壬��Bͬ����һ���ᣬ��F�����ᣬB�����ᣬ��������A�ת������A������������������ϡ���ᷴӦ�����Ȼ���������ϡ������ʷ�Ӧ��ϵ��ͼ��
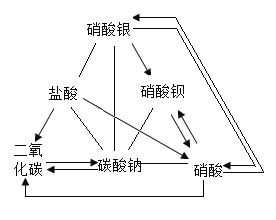
��1����ѧʽD��CO2��F��HNO3��
��2��A��C�����������Ȼ�����Ӧ�����Ȼ������������ᱵ�Ļ�ѧ����ʽ![]() ��
��
��3���������������̼���Ʒ�Ӧ�����Ȼ�����Һ�Ͷ�����̼���壬ʵ�������ǣ���ɫ�������������ݣ�����Һ�в������ݣ���������������ʧ��

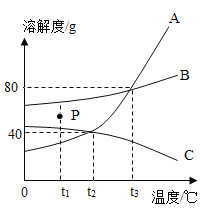
����Ŀ���ҹ�����ר�Һ�°����ġ������Ƽ��Ϊ�����Ƽҵ������ͻ�����ס�����ʳ�Ρ�ˮ��������������̼Ϊԭ�ϣ����Ƶ�̼�����ƺ��Ȼ�泥���������������±��Ǽ��������ڲ�ͬ�¶�ʱ���ܽ�ȣ�
�¶ȣ��棩 | 20 | 40 | 50 | 60 |
NaCl | 36.0 | 36.6 | 37.0 | 37.3 |
NH4C1 | 37.2 | 45.8 | 50.4 | 55.2 |
Na2CO3 | 21.8 | 48.9 | 47.5 | 46.5 |
��20��Cʱ��100��ˮ������ܽ�Na2CO3______�ˡ�
��Ҫʹ�Ȼ�隣�����Һ�е�NH4C1�ᾧ��������_____���� ���ϸߡ��ϵ͡����¶��½��бȽϺ��ʡ�
��60��Cʱ�ֱ�ȡXgNaCl��XgNH4Cl���������ֻ�ձ��У���������ʵ�顣
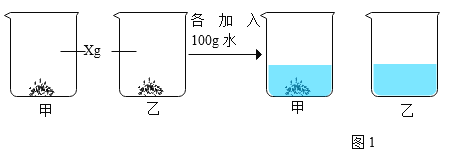
������ձ��еĹ�����_____�� ���ձ���δ�ܽ�Ĺ��������______g��Ҫʹ����ȫ���ܽ⣬�����˵ķ�����_______��
������˵����ȷ����__������ĸ��ţ�
A��������ԭ��֮һ�DZ���ʳ��ˮ�� ���������Ʊ���ʳ��ˮ����������ԼΪ26.5%��
B����������ͨ�백����������̼����Ҫ�����Щ������ܽ�ȣ���ͨ������ˮ������ߣ�
C��NH4Cl��NaCl�����Һ�п���ͨ�������ᾧ�ķ�����ý϶��NH4Cl���壻
D���������Ƽ���õ��IJ�Ʒ֮һNH4C1����Ϊ����ʹ�á�