题目内容
【题目】化学就在我们身边,与我们的生活有着密切的联系。请回答:
(1)2020年初,一场疫情席卷全球。这场疫情是由一种叫做COVID-19的病毒引起的,这种病毒可采用高温(56℃以上、30分钟)、乙醚、75%乙醇、含氯消毒剂、过氧乙酸和氯仿等脂溶剂均可有效灭活病毒。其中75%乙醇灭活病毒采用的是_____(填“物理”或“化学”)的方法。
(2)我国自主研发的复兴号动车组列车,领跑世界,其制造材料有铝合金等,在空气中铝品耐腐蚀的原因是(用化学方程式表示)_____。
(3)华为开创了“中国芯”时代。“中国芯”的主要材料是高纯度的单质硅,工业上可用二氧化硅和碳单质在高温条件下反应来制取,反应同时生成一种可燃性气体(用化学方程式表示)_____。
(4)实验室用3%~5%的碳酸氢钠溶液处理皮肤上的硫酸的原理(用化学方程式表示)_____。
(5)工业上,用纯碱为原料制取氢氧化钠的原理(用化学方程式表示)_____。
【答案】物理 4Al+3O2=2Al2O3 SiO2+2C![]() 2CO↑+Si 2NaHCO3+H2SO4=Na2SO4+2CO2↑+2H2O Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
2CO↑+Si 2NaHCO3+H2SO4=Na2SO4+2CO2↑+2H2O Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
【解析】
(1)其中75%乙醇灭活病毒,没有生成新物质,采用的是物理的方法,故填:物理。
(2)铝在空气中耐腐蚀是因为,铝在空气中和氧气生成一层致密氧化膜,阻止铝的进一步腐蚀,化学方程式为4Al+3O2=2Al2O3,故填:4Al+3O2=2Al2O3。
(3)二氧化硅和碳单质在高温条件下反应生成一种可燃性气体,根据可燃性及质量守恒,可知该气体是一氧化碳,故化学方程式为SiO2+2C![]() 2CO↑+Si,故填:SiO2+2C
2CO↑+Si,故填:SiO2+2C![]() 2CO↑+Si。
2CO↑+Si。
(4)碳酸氢钠和硫酸反应生成硫酸钠二氧化碳和水,化学方程式为:2NaHCO3+H2SO4=Na2SO4+2CO2↑+2H2O,故填:2NaHCO3+H2SO4=Na2SO4+2CO2↑+2H2O。
(5)工业上用碳酸钠和氢氧化钙反应制取氢氧化钠,化学方程式为:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH,故填:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH。

【题目】从A或B中任选一个作答,若均作答,按A计分。
A 实验室用图图装置制取O2 | B 实验室用如图装置制取CO2 |
(1)反应的化学方程式为______。 (2)说明氧气已收集满的现象是________。 |
(1)反应的化学方程式为________。 (2)用向上排空气法收集CO2的原因________。 |
【题目】我国化工专家侯德榜发明的“联合制碱法”为世界制碱工业做出了突出贡献。他以食盐、水、氨气、二氧化碳为原料,先制得碳酸氢钠和氯化铵,进而生产出纯碱。下表是几种物质在不同温度时的溶解度:
温度(℃) | 20 | 40 | 50 | 60 |
NaCl | 36.0 | 36.6 | 37.0 | 37.3 |
NH4C1 | 37.2 | 45.8 | 50.4 | 55.2 |
Na2CO3 | 21.8 | 48.9 | 47.5 | 46.5 |
①20°C时,100克水中最多溶解Na2CO3______克。
②要使氯化铵饱和溶液中的NH4C1结晶析出,在_____(填 “较高”或“较低”)温度下进行比较合适。
③60°C时分别取XgNaCl和XgNH4Cl固体加入两只烧杯中,进行如下实验。
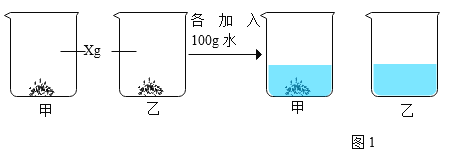
加入甲烧杯中的固体是_____。 甲烧杯中未溶解的固体最多有______g,要使固体全部溶解,最适宜的方法是_______。
④下列说法正确的是__(填字母编号)
A、该生产原料之一是饱和食盐水, 室温下配制饱和食盐水的质量分数约为26.5%;
B、生产中需通入氨气及二氧化碳,若要提高这些气体的溶解度,可通过增加水量来提高;
C、NH4Cl和NaCl混合溶液中可以通过蒸发结晶的方法获得较多的NH4Cl晶体;
D、“联合制碱法”得到的产品之一NH4C1可作为氮肥使用。