题目内容
7.化学兴趣活动小组的同学在探究金属与酸反应时,发现铜与浓硫酸在加热条件下能够发生反应,并产生大量气体.这种现象引起同学们的思考和研究,大家对产生气体的成分是什么进行了分析、讨论、猜想.【提出猜想】
猜想1:气体是H2;
猜想2:气体是SO2;
猜想3:气体是H2和SO2.
【查阅资料】
SO2易溶于水,是一种有毒气体,不能燃烧,能使红色的品红溶液变为无色,是一种主要大气污染物,能与NaOH溶液反应.H2则不能使红色品红溶液褪色.铜与浓硫酸反应时,硫酸总会剰余.
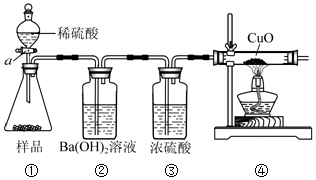
【实验方案】小组的同学设计如图所示的装置进行研究(夹持仪器已省略,假设装置中的反应都进行完全).装置C中加热仪器的名称酒精灯

【问题讨论】
①如果猜想2成立,将A中试剂换成品红溶液时(在题中资料给出物质中选填)也能检验出SO2;
如果猜想3成立的实验现象是装置A中溶液红色变浅,装置C中的黑色粉末变红色.
②装置B中浓硫酸的作用是干燥气体.
③实验结束后,有同学认为在处理铜与浓硫酸反应试管中残液时,应先用水将残液稀释,正确的操作方法是将残液慢慢地加入水中,并不断搅拌.
【思维拓展】
①实验室中用氢氧化钠溶液吸收多余的SO2,反应的化学方程式为SO2+2NaOH═Na2SO3+H2O.
②基于猜想2正确,且铜和浓硫酸在加热时铜转变为硫酸铜,试写出铜和浓硫酸在加热时的反应方程式Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O.
③资料显示:铜与浓硫酸反应时,硫酸总会剰余.请分析原因:金属活动性顺序中铜排在氢的后面,浓硫酸变稀后铜不再和硫酸反应.
分析 【实验方案】根据常见仪器的名称进行分析;
【问题讨论】①SO2能使红色的品红溶液变为无色,H2不能使红色品红溶液褪色,据此分析;
装置A中溶液红色变浅,装置C的现象为黑色粉末变红色,则气体为氢气和二氧化硫和混合气体;
②根据浓硫酸具有吸水性分析;
③根据浓硫酸的稀释方法进行分析;
【思维拓展】
①二氧化硫和氢氧化钠反应生成亚硫酸钠和水,据此分析.
②铜能与浓硫酸在加热的条件下发生反应,生成硫酸铜、二氧化硫和水,据此分析.
③金属活动性顺序中铜排在氢的后面,浓硫酸变稀后铜不再和硫酸反应,据此分析.
解答 解:【实验方案】装置C中加热仪器的名称是酒精灯,故填:酒精灯;
【问题讨论】①SO2能使红色的品红溶液变为无色,H2不能使红色品红溶液褪色,因此如果猜想2成立,可将A中试剂换成品红溶液时也能检验出SO2;
装置A中溶液红色变浅,装置C的现象为黑色粉末变红色,则气体为氢气和二氧化硫和混合气体,猜想3成立;
故填:品红;装置A中溶液红色变浅,装置C中的黑色粉末变红色;
②浓硫酸具有吸水性,用来干燥气体;故填:干燥气体;
③实验结束后,试管中的酸液浓度还是比较大,溶于水时会放出大量的热,故应先用水将残液稀释,正确的操作方法是将残液慢慢地加入水中,并不断搅拌,故填:将残液慢慢地加入水中,并不断搅拌;
【思维拓展】
①二氧化硫和氢氧化钠反应生成亚硫酸钠和水,化学方程式为:SO2+2NaOH═Na2SO3+H2O,故填:SO2+2NaOH═Na2SO3+H2O.
②铜能与浓硫酸在加热的条件下发生反应,生成硫酸铜、二氧化硫和水,反应的化学方程式为Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O,故填:Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O.
③铜与浓硫酸反应时,硫酸总会剰余,是因为金属活动性顺序中铜排在氢的后面,浓硫酸变稀后铜不再和硫酸反应,故填:金属活动性顺序中铜排在氢的后面,浓硫酸变稀后铜不再和硫酸反应.
点评 本题属于探究性实验题,可以从题干给出的内容,提取有用的信息:氢气具有还原性,二氧化硫易溶于水、和氢氧化钠反应分析归纳从而得出合理的答案.

| A. | 酒精灯着火---用湿抹布盖灭 | B. | 油锅起火---用锅盖盖灭 | ||
| C. | 汽车油箱着火---用水浇灭 | D. | 森林起火---砍伐树木形成隔离带 |
【知识回顾】能产生氢气的化学反应有:①水电解;②活泼金属与酸反应
【讨论交流】反应①中的化学方程式为2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑;;同学们讨论后认为该反应不适用于实脸室制取氢气.
【实验探究】为了探究哪种物质更适合用于实脸室制取氢气,大家设计了如下实脸:

【分析与结论】填写实验报告.
| 实验序号 | 实验现象 | 实验结论 |
| A | 剧烈反应,急速产生大量气泡,试管外壁 | 反应速率过快,气体不便收集,不适用于实验室制取氢气 |
| B | 缓慢 产生大量气泡 | 反应速率过慢,不适用于实验室制取氢气 |
| C | 较快 产生大量气泡,试管外壁发热 | 反应速率适中,适用于实验室制取氢气 |
【知识拓展】
(1)在确定实验室制取气体的反应原理时,要考虑诸多因素,如反应的快慢、收集的难易、反应条件等;
(2)由实验现象可得出镁、铁、锌金属活动性由弱到强的顺序为铁<锌<镁;
(3)用稀盐酸代替稀硫酸制取氢气时.制得的气体中可能会增加的杂质为氯化氢.
| A. | 镁条在空气中燃烧,发出耀眼的白光 | |
| B. | 细铁丝在氧气里剧烈燃烧,火星四射,生成黑色固体物质 | |
| C. | 将铝丝插入硫酸铜溶液中,溶液的颜色由蓝色逐渐变成无色 | |
| D. | 将铜丝放入一定量的稀盐酸中,产生大量的气泡 |
| A. | 从铝土矿中提取金属铝 | |
| B. | 在一定条件下,用石墨人造金刚石 | |
| C. | 二氧化碳气体经降温,加压制得干冰 | |
| D. | 排放到空气中的二氧化硫形成酸雨 |
| A. | 用汽油除去衣服上的油污 | B. | 用水洗去盘子中的水果渣 | ||
| C. | 用洗洁精清洗餐具上的油污 | D. | 用食醋清洗热水瓶中的水垢 |