题目内容
16.有一包固体,可能由硝酸铜、硫酸钠、氯化钠、碳酸钠、氢氧化钠中的一种或几种组成,为了探究该固体的组成,某化学小组设计并开展以下实验: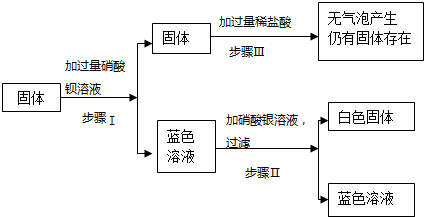
(1)原固体中一定含有的物质是硝酸铜、硫酸钠、;
(2)原固体中一定不含有的物质是碳酸钠,证据是加入过量稀盐酸,无气泡产生;
(3)步骤Ⅰ中一定产生沉淀的化学方程式是Na2SO4+Ba(NO3)2=2NaNO3+BaSO4↓;
(4)步骤Ⅱ所得的蓝色溶液中一定含有的溶质是氯化钠、硝酸钠、硝酸钡、硝酸铜;
(5)若观察到有蓝色沉淀生成现象,证明可能存在的物质确实存在.
分析 根据步骤Ⅰ中加入过量硝酸钡产生白色沉淀,说明固体中一定含有硫酸钠;溶液呈蓝色,说明固体中一定有硝酸铜;步骤Ⅱ加入过量稀盐酸,没有产生气泡,所以固体中一定不含有碳酸钠;步骤Ⅲ中加入硝酸银溶液,出现白色沉淀,则该白色沉淀为氯化银,所以溶液中一定有氯离子,一定含有氯化钠.而氢氧化钠是否存在,无法确定.
解答 解:(1)根据步骤Ⅰ中加入过量硝酸钡产生白色沉淀,说明固体中一定含有硫酸钠;溶液呈蓝色,说明固体中一定有硝酸铜;步骤Ⅱ加入过量稀盐酸,没有产生气泡,所以固体中一定不含有碳酸钠;
(2)固体加过量稀盐酸无气泡产生,所以固体中一定不含有碳酸钠;
(3)步骤Ⅰ中硝酸钡和硫酸钠反应生成硝酸钠和硫酸钡沉淀,其反应的化学方程式是:Na2SO4+Ba(NO3)2=2NaNO3+BaSO4↓;
(4)根据溶液呈蓝色,说明固体中一定有硝酸铜;加入过量硝酸钡,说明硝酸钡有剩余,所以蓝色滤液中一定含有硝酸钡;硝酸钡和硫酸钠反应生成硝酸钠和硫酸钡沉淀,所以蓝色滤液中一定含有硝酸钠,步骤Ⅲ中加入硝酸银溶液,出现白色沉淀,则该白色沉淀为氯化银,所以溶液中一定有氯离子,一定含有氯化钠.综合分析可知,蓝色滤液中一定含有的溶质是:氯化钠、硝酸钠、硝酸钡、硝酸铜.
故答案为:
(1)硝酸铜、硫酸钠;
(2)碳酸氢钠;加入过量稀盐酸,无气泡产生;
(3)Na2SO4+Ba(NO3)2=2NaNO3+BaSO4↓;
(4)硝酸、硝酸钠、硝酸钡、硝酸铜.
(5)有蓝色沉淀生成.
点评 在解此类题时,首先分析所给混合物中各物质的性质,然后根据题中所给的实验现象进行判断,最后确定混合物的组成成分.

练习册系列答案
相关题目
4.下列各组离子中,在碱性溶液里能大量共存,且溶液为无色透明的是( )
| A. | K+、MnO4-、Cu2+、SO42- | B. | Na+、CO32-、NO3-、Cl | ||
| C. | K+、Cu2+、SO42-、HCO3- | D. | K+、Na+、Cl-、SO42- |
 如图所示是Ca(OH)2的部分性质实验,回答有关问题.
如图所示是Ca(OH)2的部分性质实验,回答有关问题.