题目内容
7.实验室里用如图所示装置还原氧化铁,关于该实验下列说法正确的是( )
| A. | 玻璃管中发生的反应属于置换反应 | |
| B. | 该实验只说明了一氧化碳具有还原性 | |
| C. | 实验观察到的现象为红棕色固体变黑,澄清石灰水变浑浊 | |
| D. | 实验时,通入纯净一氧化碳的同时,点燃酒精喷灯给玻璃管加热 |
分析 A、玻璃管中发生的反应是一氧化碳与氧化铁反应生成铁和二氧化碳,据此进行分析判断.
B、根据尾气中的一氧化碳燃烧,进行分析判断.
C、玻璃管中发生的反应是一氧化碳与氧化铁反应生成铁和二氧化碳,据此判断实验现象.
D、根据可燃性气体与空气混合加热时易发生爆炸,进行分析判断.
解答 解:A、玻璃管中发生的反应是一氧化碳与氧化铁反应生成铁和二氧化碳,该反应的反应物均为化合物,不属于置换反应,故选项说法错误.
B、一氧化碳与氧化铁反应生成铁和二氧化碳,说明一氧化碳具有还原性;尾气中的一氧化碳燃烧,说明一氧化碳具有可燃性;故选项说法错误.
C、实验观察到的现象为红棕色固体变黑,澄清石灰水变浑浊,故选项说法正确.
D、一氧化碳具有可燃性,为防止发生爆炸,先通入纯净一氧化碳,将空气全部排出后,再点燃酒精喷灯给玻璃管加热,故选项说法错误.
故选:C.
点评 本题难度不大,掌握一氧化碳还原氧化铁的反应原理、实验注意事项、实验现象等是正确解答本题的关键.

练习册系列答案
相关题目
17.下列实验方法中,不能达到实验目的是( )
| A. | 用水鉴别硫酸铜固体和氢氧化钠固体 | |
| B. | 用AgNO3溶液检验H2中混入的少量HCl气体 | |
| C. | 用Ba(OH)2溶液除去NaCl溶液中的Na2CO3杂质 | |
| D. | 用稀盐酸检验暴露在空气中的NaOH固体是否变质 |
18. 如图为甲、乙两物质(均不含结晶水)的溶解度曲线,下列说法错误的是( )
如图为甲、乙两物质(均不含结晶水)的溶解度曲线,下列说法错误的是( )
 如图为甲、乙两物质(均不含结晶水)的溶解度曲线,下列说法错误的是( )
如图为甲、乙两物质(均不含结晶水)的溶解度曲线,下列说法错误的是( )| A. | 乙的饱和溶液由t2℃降温到t1℃时,溶质的质量分数不变 | |
| B. | 除去甲中含有的少量乙,可以用冷却热饱和溶液的方法 | |
| C. | t1℃时,50g水中分别加入25g的甲、乙,均可得到75g的饱和溶液 | |
| D. | t1℃时,等质量甲、乙两物质的饱和溶液蒸发等质量的水,所得溶液中溶质的质量一定相等 |
15.每年的6月5日是世界环境日,建立世界环境日的目的是:倡导人们在日常生活中节约能源,减少二氧化碳的排放.下列做法不符合该目的是( )
| A. | 购物时用布袋代替塑料袋 | B. | 外出尽量步行或骑自行车 | ||
| C. | 充分利用太阳能 | D. | 直接燃烧煤炭 |
2.小王同学对所学部分化学知识归纳如下,其中有错误的一组是( )
| A.物质区别 | B.灭火方法 |
| 区分食盐水和蛋白质溶液--用饱和 (NH4)2SO4溶液 | 电器着火--切断电源,用液态二氧化碳灭火器灭火 |
| C.实验记录 | D.生活常识 |
| 用10ml量筒量取7.25mL水 | 用洗涤剂洗油污--乳化作用 |
| A. | 物质区别 | B. | 灭火方法 | C. | 实验记录 | D. | 生活常识 |
12.工业上常利用电石制乙炔气体(C2H2)时产生的灰浆和残渣制备化工原料KClO3和超细CaCO3.
(1)电石制乙炔气体(C2H2)时产生灰浆和残渣的过程如下:电石(CaC2)$\stackrel{水}{→}$灰浆$\stackrel{露置于空气}{→}$残渣
其中电石与水反应生成氢氧化钙和乙炔,写出该反应的化学方程式CaC2+2H2O=Ca(OH)2+C2H2↑.残渣中主要成分是Ca(OH)2和CaCO3.
Ⅰ.制备KClO3的流程如图:
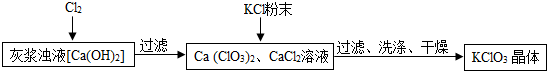
(2)向灰浆浊液中通入Cl2,得到Ca(ClO3)2、CaCl2溶液.反应中Ca(ClO3)2与CaCl2的化学计量数分别为1和5.写出此反应的化学方程式6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O.
(3)有关物质在常温下的溶解度如下:
上述流程中加入KCl粉末,KCl与Ca(ClO3)2(填化学式)发生了复分解反应,得到KClO3晶体.你认为能得到KClO3 晶体的原因是KClO3在常温下溶解度较小.
(4)洗涤时,可选用下列BC洗涤剂(填字母编号).
A.KCl饱和溶液 B.冰水 C.饱和KClO3溶液
Ⅱ.制备超细CaCO3的流程如下(注:加入NH4Cl溶液的目的是溶解残渣中的难溶盐):
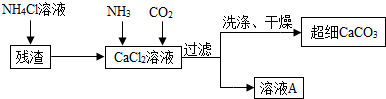
(5)向CaCl2溶液中通入两种气体,生成超细CaCO3的化学方程式CaCl2+2NH3+CO2+H2O=CaCO3↓+2NH4Cl.检验CaCO3是否洗涤干净的方法是取最后一次的洗涤液加硝酸银溶液,如有沉淀生成则没有洗干净,反之以洗干净.
(6)流程中溶液A可循环使用,其主要成分的化学式是NH4Cl.
(1)电石制乙炔气体(C2H2)时产生灰浆和残渣的过程如下:电石(CaC2)$\stackrel{水}{→}$灰浆$\stackrel{露置于空气}{→}$残渣
其中电石与水反应生成氢氧化钙和乙炔,写出该反应的化学方程式CaC2+2H2O=Ca(OH)2+C2H2↑.残渣中主要成分是Ca(OH)2和CaCO3.
Ⅰ.制备KClO3的流程如图:

(2)向灰浆浊液中通入Cl2,得到Ca(ClO3)2、CaCl2溶液.反应中Ca(ClO3)2与CaCl2的化学计量数分别为1和5.写出此反应的化学方程式6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O.
(3)有关物质在常温下的溶解度如下:
| 物质 | Ca(ClO3)2 | CaCl2 | KClO3 | KCl |
| 溶解度/g | 209.0 | 74.5 | 7.3 | 34.2 |
(4)洗涤时,可选用下列BC洗涤剂(填字母编号).
A.KCl饱和溶液 B.冰水 C.饱和KClO3溶液
Ⅱ.制备超细CaCO3的流程如下(注:加入NH4Cl溶液的目的是溶解残渣中的难溶盐):

(5)向CaCl2溶液中通入两种气体,生成超细CaCO3的化学方程式CaCl2+2NH3+CO2+H2O=CaCO3↓+2NH4Cl.检验CaCO3是否洗涤干净的方法是取最后一次的洗涤液加硝酸银溶液,如有沉淀生成则没有洗干净,反之以洗干净.
(6)流程中溶液A可循环使用,其主要成分的化学式是NH4Cl.
16.向质量为m克的CaCO3和KHCO3的混合物中,加入质量分数为a%的稀盐酸n克,恰好完全反应后,得到二氧化碳的质量是w克.下列说法正确的是( )
| A. | 混合物中CaCO3和KHCO3的质量比一定是1:1 | |
| B. | 混合物充分反应后,所得溶液的质量是(m+n-w)克 | |
| C. | 混合物中CaCO3和KHCO3无论以任何比例混合,消耗稀盐酸的总质量均为n克 | |
| D. | 混合物中CaCO3和KHCO3无论以任何比例混合,生成二氧化碳的总质量均为w克 |
 厉山中心学校的聪聪同学为了比较铁、铜和未知金属X的活动性大小,设计了如图所示实验.
厉山中心学校的聪聪同学为了比较铁、铜和未知金属X的活动性大小,设计了如图所示实验.