题目内容
【题目】钢铁是使用最多的金属材料。
(1)早在春秋战国时期,我国就开始生产和使用铁器。现代工厂以磁铁矿(主要成分 Fe3O4)为原料炼铁的化学方程式为___。
(2)利用新技术能将不锈钢加工成柔软的金属丝,用它和棉纤维一起编织成性能优良的劳保防护服,这是利用了不锈钢____。
A 延展性 B 导热性 C 导电性
(3)向硫酸和硫酸铜混合溶液中加入一定量的铁粉(足量),充分反应后过滤、洗涤、干燥,固体质量不变,则原混合溶液中硫酸和硫酸铜的质量比为_____。
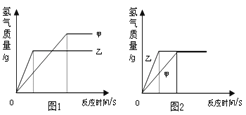
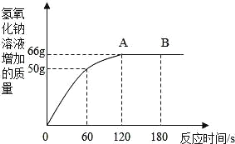
(4)为探究铁和锌两种金属与酸反应的状况,将等质量的两种金属分别与等质量的溶质质量分数相同的稀硫酸反应,产生氢气的质量与反应时间的函数关系如下图所示。下列相关判断中,正确的是_____。
A 甲是铁,乙是锌
B 甲是锌,乙是铁
C 图1中金属乙与稀硫酸充分反应后,稀硫酸一定还有剩余
D 图2中金属甲与硫酸充分反应后,金属甲可能有剩余
【答案】![]() A 7:80 ACD
A 7:80 ACD
【解析】
(1)四氧化三铁和一氧化碳反应生成铁和二氧化碳的化学方程式为:![]() ;
;
(2)利用新技术能将不锈钢加工成柔软的金属丝,用它和棉纤维一起编织成性能优良的劳保防护服,这是利用了不锈钢的耐腐蚀性和延展性;
(3)完全反应后剩余固体物质的质量与所加铁粉的质量相等,则参加反应的铁的质量等于生成的铜的质量,
![]()
生成铜的质量为64,则需要硫酸铜的质量160,与硫酸铜反应的铁的质量的56,属于与硫酸反应的铁的质量为64-56=8,设消耗硫酸的质量为x,

![]()
x=14,
原混合液中硫酸和硫酸铜的质量比为:14:160=7:80;
(4)在金属活动性顺序中,氢前的金属能与酸反应生成氢气,金属的位置越靠前,反应的越剧烈,在坐标中斜线越陡,观察现象,甲表示的是铁,乙表示的是锌;当酸量不足,酸全部参加反应时,生成的氢气质量相同,当酸足量时,铁生成的氢气质量大于锌生成的氢气的质量,观察图1,甲的反应速率慢,表示的是铁,乙的反应速率快,表示的是锌,甲产生的氢气大于乙生成的氢气,表示酸足量,金属全部参加反应,观察图2,产生的氢气质量相同,表明酸全部参加反应,金属可能有剩余。

 智慧小复习系列答案
智慧小复习系列答案