题目内容
【题目】初中化学学习中,我们初步认识了物质的微观结构。
(1)氯化钠、金刚石、干冰三种物质中,由离子构成的物质是_____
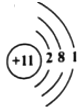
(2)如图是某粒子的结构示意图,该粒子在化学反应中容_____电子(填“得到”或“失去”)。与元素的化学性质关系最密切的是原子的_____.
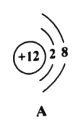
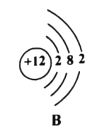
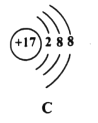
(3)下图中A、B、C、D是四种粒子的结构示意图。

回答下列问题:
①图中A、B、C、D属于_____种元素的粒子;
②A、B、C、D四种粒子中,不具备稳定结构的是_____(填序号);
③D中x=_____;
④A与C形成化合物的化学式是_____。
【答案】氯化钠或![]() 失去 最外层电子数 3 B 8
失去 最外层电子数 3 B 8 ![]() 或
或![]()
【解析】
(1)氯化钠是由钠离子和氯离子构成的离子型化合物,金刚石是由碳原子直接构成的非金属单质,干冰是由分子构成的非金属化合物,故填:氯化钠(NaCl);
(2)由该粒子的结构示意图可知,最外层电子数为1,小于4,在化学反应中容易失去1个电子,形成带1个单位正电荷的阳离子,故填失去;与元素的化学性质关系最密切的是原子的最外层电子数,故填:最外层电子数;
(3)
①不同元素最本质的区别是质子数不同,图中微粒A、B质子数相同,属于同种元素, C和D和A、B质子数不同,属于不同种元素,共有3种元素,故填:3;
②最外层电子数为8的称为稳定结构(只有1个电子层的是2个电子达到稳定结构),D中质子数为18,是稀有气体元素氩,最外层电子数x=18-2-8=8,只有B粒子最外层电子数为2,不具备稳定结构,故填:B;
③由上分析可知D中x=8,故填:8;
④A中质子数为12,核外电子数是10,是带两个单位正电荷的镁离子, C的质子数是17,核外电子数是18,是带有1个单位负电荷的氯离子,二者形成化合物的化学式是MgCl2或AC2,故填:MgCl2或AC2。

【题目】实验室有一瓶碳酸钙和氯化钙粉末组成的均匀混合物,小明用相同溶质质量分数的稀盐酸和该混合物反应(所得溶液均为不饱和溶液),四组实验数据记录如表,请分析计算(写出计算过程)
实验组别 | 一 | 二 | 三 | 四 |
稀盐酸质量/g | 100.0 | 100.0 | 100.0 | 100.0 |
混合物质量/g | 3.0 | 6.0 | 9.0 | 12.0 |
所得溶液质量/g | 101.9 | 103.8 | 105.0 | a |
剩余固体质量/g | 0 | 0 | m | n |
(1)求混合物中碳酸钙和氯化钙质量之比__________
(2)表中a的值为_______。
(3)求表中m的值__________。