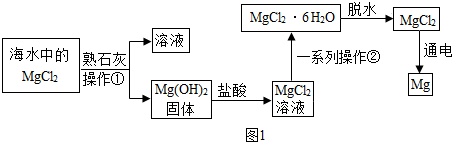
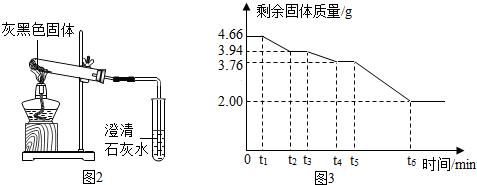
题目内容
4.选择下列适当的物质填空(填字母序号):A.活性炭 B.不锈钢 C.纯碱 D.硝酸钾
E.维生素 F.硫酸 G.蛋白质 H.烧碱
(1)复合肥料D. (2)可用于制造医疗器械的是B;
(3)侯氏制碱法制得的“碱”是C; (4)铅蓄电池中的酸F;
(5)蔬菜、水果中富含E; (6)可用于冰箱除味的是A.
分析 物质的性质决定物质的用途,根据已有的物质的性质进行分析解答即可.
解答 解:(1)硝酸钾中含有钾元素和氮元素,属于复合肥,故填:D;
(2)不锈钢可以用于制造医疗器械,故填:B;
(3)侯氏制碱法制得的碱是纯碱碳酸钠,故填:C;
(4)铅蓄电池中的酸是稀硫酸,故填:F;
(5)蔬菜水果中富含维生素,故填:E;
(6)活性炭具有吸附性,能用于除去冰箱内的异味,故填:A.
点评 本题考查的是常见的物质的用途,完成此题,可以依据已有的物质的性质进行.

练习册系列答案
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案
相关题目
14.据《文汇报》报道,香港大学医学院及玛丽医院成功研发“口服砒霜”,近10年来,已有逾100位血癌病人服用药后康复出院,该药很快将会推广至全球,砒霜的学名为三氧化二砷,化学式为As2O3,能与生石灰发生反应,它属于一种( )
| A. | 金属氧化物 | B. | 有机物 | C. | 非金属氧化物 | D. | 盐 |
15. 同学们发现NaOH溶液与NaHCO3溶液混合后无明显现象,产生疑问:两种物质是否发生了化学反应?在老师的帮助下,他们通过以下探究过程证明NaHCO3溶液与NaOH溶液发生了反应.
同学们发现NaOH溶液与NaHCO3溶液混合后无明显现象,产生疑问:两种物质是否发生了化学反应?在老师的帮助下,他们通过以下探究过程证明NaHCO3溶液与NaOH溶液发生了反应.
(1)实验准备
①查阅资料:NaHCO3+NaOH═Na2CO3+H2O
②用一定溶质质量分数的NaHCO3、NaOH和Na2CO3三种溶液进行如下实验,为设计实验方案提供参考.
表中的现象Ⅰ为有气泡产生,现象Ⅱ对应反应的化学方程式为Na2CO3+Ca(OH)2═CaCO3↓+2NaOH.
(2)实验过程
【实验1】证明反应生成了Na2CO3同学们选用上表实验中的药品,设计了如图所示实验:先在NaHCO3溶液中加入A溶液,无明显现象,再滴加NaOH溶液,溶液变浑浊,则A溶液是CaCl2.有同学提出这个实验不足以证明有Na2CO3生成,其理由是CaCl2 和NaOH反应生成Ca(OH)2,氢氧化钙是微溶物,在溶液中也产生沉淀;为了证明有Na2CO3生成,需要继续进行的操作是取少量反应后滤渣加入足量的稀盐酸,若产生无色气体证明有Na2CO3生成,反之则没有.
【实验2】证明反应后NaHCO3不存在同学们参考上表中的实验,又设计了一个实验,虽然没有观察到明显的实验现象,但可以证明反应发生了,该实验方案是取少量反应后的溶液加热至沸腾,将气体通入澄清石灰水,若澄清石灰水变浑浊,证明有:NaHCO3存在,反之则没有.
(3)实验反思
通过实验1和实验2说明,对于没有明显现象的化学反应,可以从两个不同的角度证明反应的发生,这两个角度是一是可以通过检验反应物证明反应发生,二是可以通过检验产物证明反应发生.
 同学们发现NaOH溶液与NaHCO3溶液混合后无明显现象,产生疑问:两种物质是否发生了化学反应?在老师的帮助下,他们通过以下探究过程证明NaHCO3溶液与NaOH溶液发生了反应.
同学们发现NaOH溶液与NaHCO3溶液混合后无明显现象,产生疑问:两种物质是否发生了化学反应?在老师的帮助下,他们通过以下探究过程证明NaHCO3溶液与NaOH溶液发生了反应.(1)实验准备
①查阅资料:NaHCO3+NaOH═Na2CO3+H2O
②用一定溶质质量分数的NaHCO3、NaOH和Na2CO3三种溶液进行如下实验,为设计实验方案提供参考.
| NaHCO3溶液 | NaOH溶液 | Na2CO3溶液 | |
| 加入稀盐酸 | 现象Ⅰ | 无明显变化 | 产生气泡 |
| 加入澄清石灰水 | 溶液变浑浊 | 无明显变化 | 现象Ⅱ |
| 加入CaCl2溶液 | 无明显变化 | 溶液变浑浊 | 溶液变浑浊 |
| 加热溶液至沸腾,将气体通入澄清石灰水 | 澄清石灰水 变浑浊 | 澄清石灰水 无明显变化 | 澄清石灰水 无明显变化 |
(2)实验过程
【实验1】证明反应生成了Na2CO3同学们选用上表实验中的药品,设计了如图所示实验:先在NaHCO3溶液中加入A溶液,无明显现象,再滴加NaOH溶液,溶液变浑浊,则A溶液是CaCl2.有同学提出这个实验不足以证明有Na2CO3生成,其理由是CaCl2 和NaOH反应生成Ca(OH)2,氢氧化钙是微溶物,在溶液中也产生沉淀;为了证明有Na2CO3生成,需要继续进行的操作是取少量反应后滤渣加入足量的稀盐酸,若产生无色气体证明有Na2CO3生成,反之则没有.
【实验2】证明反应后NaHCO3不存在同学们参考上表中的实验,又设计了一个实验,虽然没有观察到明显的实验现象,但可以证明反应发生了,该实验方案是取少量反应后的溶液加热至沸腾,将气体通入澄清石灰水,若澄清石灰水变浑浊,证明有:NaHCO3存在,反之则没有.
(3)实验反思
通过实验1和实验2说明,对于没有明显现象的化学反应,可以从两个不同的角度证明反应的发生,这两个角度是一是可以通过检验反应物证明反应发生,二是可以通过检验产物证明反应发生.
12. 两会时“实名制”矿泉水亮相,服务员们“沏茶倒水”的场景不再出现,取而代之的是为每名委员提供一瓶矿泉水,而且每瓶矿泉水上还贴有委员名字.相关说法不正确的是( )
两会时“实名制”矿泉水亮相,服务员们“沏茶倒水”的场景不再出现,取而代之的是为每名委员提供一瓶矿泉水,而且每瓶矿泉水上还贴有委员名字.相关说法不正确的是( )
 两会时“实名制”矿泉水亮相,服务员们“沏茶倒水”的场景不再出现,取而代之的是为每名委员提供一瓶矿泉水,而且每瓶矿泉水上还贴有委员名字.相关说法不正确的是( )
两会时“实名制”矿泉水亮相,服务员们“沏茶倒水”的场景不再出现,取而代之的是为每名委员提供一瓶矿泉水,而且每瓶矿泉水上还贴有委员名字.相关说法不正确的是( )| A. | 矿泉水属于溶液 | |
| B. | 水是人体六大类营养物质之一 | |
| C. | 矿泉水中的矿物质钙、锌、铁、硒都属于人体需要的微量元素 | |
| D. | 灌装矿泉水的塑料瓶子由聚乙烯材料制作而成 |
19.现有MgO和Mg的混合物6.4g,将该混合物加入100g某稀硫酸中,恰好反应,把反应所得溶液蒸干,得到固体24g.下列说法正确的是( )
| A. | 生成H2的质量为0.2g | |
| B. | 该稀硫酸的溶质质量分数为9.8% | |
| C. | 反应过程中溶液的温度没有明显改变 | |
| D. | 反应前后溶液中水的质量保持不变 |
16.物质世界充满了变化,下列变化中,属于化学变化的是( )
| A. | 燃放烟花 | B. | 滴水成冰 | C. | 海水晒盐 | D. | 辣椒剁碎 |
13. 如图是两种元素在周期表中的信息.下列说法正确的是( )
如图是两种元素在周期表中的信息.下列说法正确的是( )
 如图是两种元素在周期表中的信息.下列说法正确的是( )
如图是两种元素在周期表中的信息.下列说法正确的是( )| A. | 氧的相对原子质量是16.00g | B. | 铝原子的质子数是13 | ||
| C. | 氧化铝的化学式AlO | D. | 两种元素都是金属元素 |
14.用下列装置进行实验,不能达到实验目的是( )
| A. |  收集CO2 | B. |  收集O2 | C. |  验证CO2性质 | D. |  监控气体流 |