题目内容
1.煤在燃烧过程中会产生各种废气,其中能形成酸雨的气体是NO2和SO2.依据酸所具有的性质,判断酸雨对下列物品有损害的是ABCD(填字母序号).A.大理石塑像 B.铝制门窗 C.钢铁结构大桥 D.花草树木.
分析 根据能形成酸雨的气体是二氧化氮和二氧化硫以及酸雨的危害进行解答.
解答 解:二氧化氮和二氧化硫能与水反应生成酸,形成酸雨,酸雨能对大理石塑像、铝制门窗、钢铁结构大桥、花草树木造成伤害.
故答案为:
NO2和SO2;ABCD
点评 本考点的基础性比较强,主要出现在选择题和填空题中,从生活的实际出发,可激发同学们学习的兴趣.

练习册系列答案
相关题目
16.资料表明:在不同温度下,CO可将Fe2O3还原为Fe、Fe3O4中的一种或两种.为探究温度对该反应产物的影响,进行如下实验.
【查阅资料】
Ⅰ.Fe3O4与盐酸反应,得到FeCl2和FeCl3的混合溶液
Ⅱ.用溶质质量分数一定的FeCl2和FeCl3溶液进行如下实验,为方案设计提供参考
【实验过程】
甲、乙两组同学分别用酒精灯和酒精喷灯作为热源进行CO还原Fe2O3的实验,检验得到的黑色固体的成分,完成如表实验报告.
【实验反思】
(1)结合此次探究活动,你认为下列说法正确的是abcd(填字母序号).
a.温度会影响反应的产物 b.进行CO还原Fe2O3的实验时,一定要进行尾气处理
c.KSCN溶液可用于检验FeCl3溶液 d.得到的黑色固体的质量一定小于参加反应的Fe2O3的质量
(2)乙组的实验结论有欠缺,请你分析原因若固体是Fe和Fe3O4的混合物,过量的Fe可与FeCl3反应生成FeCl2,加入KSCN溶液同样能观察到溶液无明显变化.
【查阅资料】
Ⅰ.Fe3O4与盐酸反应,得到FeCl2和FeCl3的混合溶液
Ⅱ.用溶质质量分数一定的FeCl2和FeCl3溶液进行如下实验,为方案设计提供参考
| FeCl2溶液 | FeCl3溶液 | |
| 加入Fe粉 | 无明显变化 | 溶液变成浅绿色 |
| 加KSCN溶液 | 无明显变化 | 溶液变成红色 |
甲、乙两组同学分别用酒精灯和酒精喷灯作为热源进行CO还原Fe2O3的实验,检验得到的黑色固体的成分,完成如表实验报告.
| 实验操作 | 实验现象 | 结论与解释 |
| ①取少量的黑色固体于试管中,滴加适量的稀盐酸 ②向步骤①所得的溶液中,滴加KSCN溶液 | 甲组: 固体溶解,无气泡冒出 加KSCN溶液后,溶液变成红色 | 甲组用CO还原Fe2O3反应的化学方程式是CO+3Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe3O4+CO2 |
| 乙组: 固体溶解,有气泡冒出 加KSCN溶液后,溶液颜色无明显变化 | 黑色固体的成分是Fe |
(1)结合此次探究活动,你认为下列说法正确的是abcd(填字母序号).
a.温度会影响反应的产物 b.进行CO还原Fe2O3的实验时,一定要进行尾气处理
c.KSCN溶液可用于检验FeCl3溶液 d.得到的黑色固体的质量一定小于参加反应的Fe2O3的质量
(2)乙组的实验结论有欠缺,请你分析原因若固体是Fe和Fe3O4的混合物,过量的Fe可与FeCl3反应生成FeCl2,加入KSCN溶液同样能观察到溶液无明显变化.
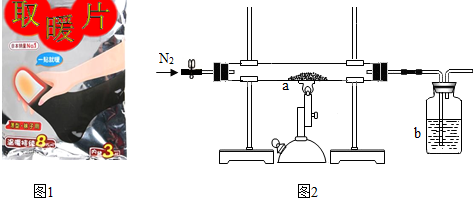
10.铁是生活中常用的金属,如图1是某“取暖片”外包装的图片.该“取暖片”中发热剂主要成分有铁粉、氯化钠、水、活性炭等,其发热是利用铁生锈时会放热的原理.
(1)发热剂需接触到空气才会发热,原因是铁要与氧气、水共同作用才会生锈.
(2)“取暖片”中的氯化钠作用是②(填序号)
①溶于水放热 ②加快铁生锈 ③没有任何用途
(3)化学兴趣小组的甲、乙二位同学对“取暖片”的成分产生了兴趣.
Ⅰ.甲同学测定新的“取暖片”中铁粉的含量.取5.7g“取暖片”样品,投入装有10.0g稀盐酸(足量)的烧杯(烧杯质量10.0g)中.在化学反应过程中对烧杯进行了五次称量,数据记录如下表:
①表格中m的值为25.5克;②5.7g“取暖片”样品中铁粉的质量为5.6克
Ⅱ.乙同学测定一包已变质“取暖片”中Fe2O3的质量分数.取10g已变质“取暖片”样品与过量的木炭粉混合,如图2所示装置完成实验.
①实验中加热前要缓缓通入一段时间氮气,作用是排净装置内的空气.停止加热后还要缓缓通入一段时间氮气,否则会导致测定的结果偏小(填“偏大”、“偏小”).
②充分反应后,乙同学测定b中的试剂增加了3.3g,b中的试剂是氢氧化钠溶液,发生反应的化学方程式为CO2+2NaOH═Na2CO3+H2O.
③请帮乙同学求出已变质的“取暖片”样品中Fe2O3的质量分数.
(1)发热剂需接触到空气才会发热,原因是铁要与氧气、水共同作用才会生锈.

(2)“取暖片”中的氯化钠作用是②(填序号)
①溶于水放热 ②加快铁生锈 ③没有任何用途
(3)化学兴趣小组的甲、乙二位同学对“取暖片”的成分产生了兴趣.
Ⅰ.甲同学测定新的“取暖片”中铁粉的含量.取5.7g“取暖片”样品,投入装有10.0g稀盐酸(足量)的烧杯(烧杯质量10.0g)中.在化学反应过程中对烧杯进行了五次称量,数据记录如下表:
| 反应时间 | t0 | t1 | t2 | t3 | t4 |
| 烧杯和药品质量/g | 25.7 | 25.6 | 25.5 | 25.5 | m |
Ⅱ.乙同学测定一包已变质“取暖片”中Fe2O3的质量分数.取10g已变质“取暖片”样品与过量的木炭粉混合,如图2所示装置完成实验.
①实验中加热前要缓缓通入一段时间氮气,作用是排净装置内的空气.停止加热后还要缓缓通入一段时间氮气,否则会导致测定的结果偏小(填“偏大”、“偏小”).
②充分反应后,乙同学测定b中的试剂增加了3.3g,b中的试剂是氢氧化钠溶液,发生反应的化学方程式为CO2+2NaOH═Na2CO3+H2O.
③请帮乙同学求出已变质的“取暖片”样品中Fe2O3的质量分数.


