题目内容
14.聊城东昌湖水面辽阔、风景秀丽、江堤乐园环境优越,田园风光独特,空气清晰,风光旖旎,初三、二班的几位同学在一周末实地感受了两个地方的美.(1)刚进入乐园,阵阵花香扑鼻而来,让几位同学兴奋不已,用微粒观点解释闻到花香是因为分子是不断运动的.
(2)在乐园内的一个路口,同学们看见几株小树枝叶已发黄,从施肥的角度分析,这些小树主要应该补充的化肥是A(填字母序号);
A.NH4Cl B.K2SO4 C.Ca(H2PO4)2
(3)大伙一路谈笑,口渴了,拿出随身带来的塑料瓶装的矿泉水,饮后观察了标签,上面有一项写着:含钙、镁、钠、钾等成分,这里的“钙”、“镁”、“钠”、“钾”指的是元素(填“原子”、“离子”、“元素”、“物质”);
(4)他们来到了东昌湖边,发现河水清澈透明,如果要测定该湖水的酸碱度,应选用C(填字母序号)
A.石蕊试液 B.酚酞试液 C.pH试纸.
分析 (1)根据分子是不断运动的特征分析回答;
(2)根据小树的症状分析缺乏的元素,判断应施用的化肥;
(3)根据物质的组成常用元素来描述分析回答;
(4)测定该溶液的酸碱度最简便的方法是使用pH试纸.
解答 解:(1)刚进入乐园,阵阵花香扑鼻而来,让几位同学兴奋不已,用微粒观点解释闻到花香是因为:分子是不断运动的,花香的微粒通过运动分散到周围的空气中.
(2)在乐园内的一个路口,同学们看见几株小树枝叶已发黄,从施肥的角度分析,这些小树主要缺乏氮元素,应该补充的化肥是氮肥,故选A.
(3)物质的组成常用元素来描述,矿泉水标签中的“钙”、“镁”、“钠”、“钾”指的是元素.
(4)要测定该湖水的酸碱度,应选用pH试纸最简便.
故答为:(1)分子是不断运动的.(2)A.(3)元素.(4)C.
点评 本题联系生活比较紧密,体现了生活中处处有化学,能利用化学知识来解释生活中的某些问题.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
5.对下列现象的解释或结论不正确的是( )
| A. | 湿衣服晾干-分子在不断运动 | |
| B. | 铁制品在潮湿的空气中容易生锈-是因为铁能与氧气、水蒸气发生缓慢氧化 | |
| C. | 铝制品具有抗腐蚀性-铝的化学性质不活泼 | |
| D. | 洗洁精能去除油污-是因为洗洁精具有乳化作用 |
2.下列实验操作中,正确的是( )
| A. |  检验CO2是否集满 | B. |  加热液体 | ||
| C. |  滴加液体 | D. |  称量NaOH固体质量 |
9. 如图是甲、乙两种固体的溶解度曲线,下列说法中不正确的是( )
如图是甲、乙两种固体的溶解度曲线,下列说法中不正确的是( )
 如图是甲、乙两种固体的溶解度曲线,下列说法中不正确的是( )
如图是甲、乙两种固体的溶解度曲线,下列说法中不正确的是( )| A. | 10℃时,甲和乙的溶解度相等 | |
| B. | 甲的溶解度受温度影响比乙大 | |
| C. | 20℃时,将25g甲加入50g水中,可形成75g溶液 | |
| D. | 将30℃时甲的饱和溶液降温至10℃,有晶体析出 |
19.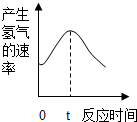 探究影响化学反应速率的因素
探究影响化学反应速率的因素
(1)发现和提出问题
镁在空气中能够剧烈燃烧,铁丝在氧气中能够剧烈燃烧,而真金不怕火炼,这说明决定物质之间能否发生反应以及反应速率的内因是反应物本身的性质.
蜡烛在氧气中燃烧比在空气中燃烧剧烈,这一事例中影响化学反应速率的因素是氧气的浓度;夏天,将食品放在冰箱里不容易变质,这一事例说明温度也能影响化学反应速率,温度如何影响反应速率呢?
(2)猜想与假设
温度越高,反应速率越快
(3)收集证据
实验药品:颗粒大小相同的锌粒;两份相同溶质质量分数.不同温度的稀硫酸(20℃、40℃)
供选仪器:药匙、气体发生装置2套(气密性良好)、量筒2支、分液漏斗、秒表、胶头滴管、水槽、大试管2支.利用上述仪器和药品,补充完成下表的实验报告.
该实验可以观察或测量的量有多种,除了上述观测点外,可以观察或测量的量还有(写一条)相同时间内收集气体的体积(或反应结束所需的时间或消耗等量的锌粒所需的时间或消耗等量的稀硫酸所需的时间)等.
(4)结论与解释
从微观的角度分析“温度越高,反应速率越快”的原因是温度升高,粒子的运动的速率加快,有效碰撞机会增加.
(5)拓展分析
根据其他测定方位,实验小组的同学绘制了锌粒与稀硫酸反应产生氢气的速率随时间变化的曲线,如图所示,请据图分析:时间0-t内,反应速率逐渐加快的主要原因是锌与稀硫酸反应放热,温度升高,反应速率加快,时间t以后,反应速率逐渐减慢的主要原因是随着反应的进行,反应物的浓度越来越小,反应速率减慢.
 探究影响化学反应速率的因素
探究影响化学反应速率的因素(1)发现和提出问题
镁在空气中能够剧烈燃烧,铁丝在氧气中能够剧烈燃烧,而真金不怕火炼,这说明决定物质之间能否发生反应以及反应速率的内因是反应物本身的性质.
蜡烛在氧气中燃烧比在空气中燃烧剧烈,这一事例中影响化学反应速率的因素是氧气的浓度;夏天,将食品放在冰箱里不容易变质,这一事例说明温度也能影响化学反应速率,温度如何影响反应速率呢?
(2)猜想与假设
温度越高,反应速率越快
(3)收集证据
实验药品:颗粒大小相同的锌粒;两份相同溶质质量分数.不同温度的稀硫酸(20℃、40℃)
供选仪器:药匙、气体发生装置2套(气密性良好)、量筒2支、分液漏斗、秒表、胶头滴管、水槽、大试管2支.利用上述仪器和药品,补充完成下表的实验报告.
| 观察或测量的量 | 选用的仪器 | 实验步骤 | 实验现象 | 实验结论 |
| 产生相同体积(一试管)的气体所需时间 | 气体发生装置、秒表、胶头滴管、水槽、大试管、 药匙、量筒 | 温度越高,反应速率越快.反应的化学方程式是Zn+H2SO4═ZnSO4+H2↑ |
(4)结论与解释
从微观的角度分析“温度越高,反应速率越快”的原因是温度升高,粒子的运动的速率加快,有效碰撞机会增加.
(5)拓展分析
根据其他测定方位,实验小组的同学绘制了锌粒与稀硫酸反应产生氢气的速率随时间变化的曲线,如图所示,请据图分析:时间0-t内,反应速率逐渐加快的主要原因是锌与稀硫酸反应放热,温度升高,反应速率加快,时间t以后,反应速率逐渐减慢的主要原因是随着反应的进行,反应物的浓度越来越小,反应速率减慢.
6. 甲、乙两种物质的溶解度曲线如图所示,下列说法正确的是( )
甲、乙两种物质的溶解度曲线如图所示,下列说法正确的是( )
 甲、乙两种物质的溶解度曲线如图所示,下列说法正确的是( )
甲、乙两种物质的溶解度曲线如图所示,下列说法正确的是( )| A. | t1℃时甲的饱和溶液,升温至t2℃时仍是饱和溶液 | |
| B. | 乙的溶解度随温度的升高而增大 | |
| C. | 相同温度时,甲的溶解度一定大于乙的溶解度 | |
| D. | 分别将甲、乙的饱和溶液从t2℃降至t1℃时,所得溶液中溶质的质量分数相等 |
4.根据所学的化学知识,判断下叙述中正确的是( )
| A. | NO3-、Cl-、Na+、Ag+四种离子能在pH=2的水溶液中大量共存 | |
| B. | 可用氢氧化钙溶液除去氢氧化钠溶液中含有的少量碳酸钠 | |
| C. | 将铜粉放入到硫酸亚铁溶液中,溶液由浅绿色变为蓝色 | |
| D. | 用燃着的木条可以将氧气、氮气、二氧化碳区别开来 |
 2015年12月,某餐厅发生一起爆炸事故,现场伴有大量浓烟冒出,距离事故发生地一千米左右,还能闻到浓浓的刺鼻味.消防部门第一时间赶到现场,扑灭大火,减少了人员伤亡和财产损失.根据要求回答问题:
2015年12月,某餐厅发生一起爆炸事故,现场伴有大量浓烟冒出,距离事故发生地一千米左右,还能闻到浓浓的刺鼻味.消防部门第一时间赶到现场,扑灭大火,减少了人员伤亡和财产损失.根据要求回答问题: 水是人们生活生产中应用最多的物质:
水是人们生活生产中应用最多的物质: