题目内容
6. 甲、乙两种物质的溶解度曲线如图所示,下列说法正确的是( )
甲、乙两种物质的溶解度曲线如图所示,下列说法正确的是( )| A. | t1℃时甲的饱和溶液,升温至t2℃时仍是饱和溶液 | |
| B. | 乙的溶解度随温度的升高而增大 | |
| C. | 相同温度时,甲的溶解度一定大于乙的溶解度 | |
| D. | 分别将甲、乙的饱和溶液从t2℃降至t1℃时,所得溶液中溶质的质量分数相等 |
分析 根据题目信息和溶解度曲线可知:甲固体物质的溶解度,是随温度升高而增大,而乙的溶解度先随温度的升高增大,后随温度的升高而减小;t1℃时甲的饱和溶液,升温至t2℃时变成不饱和溶液,仍是饱和溶液错误;乙的溶解度随温度的升高而增大错误,因为没有指明温度;温度时,甲的溶解度一定大于乙的溶解度错误,因为没有指明温度;分别将甲、乙的饱和溶液从t2℃降至t1℃时,所得溶液中溶质的质量分数相等正确,因为降温后,甲和乙的溶解度相同.
解答 解:A、t1℃时甲的饱和溶液,升温至t2℃时变成不饱和溶液,仍是饱和溶液错误;故选项错误;
B、乙的溶解度随温度的升高而增大错误,因为没有指明温度;故选项错误;
C、温度时,甲的溶解度一定大于乙的溶解度错误,因为没有指明温度;故选项错误;
D、分别将甲、乙的饱和溶液从t2℃降至t1℃时,所得溶液中溶质的质量分数相等正确,因为降温后,甲和乙的溶解度相同,故选项正确;
故选D
点评 本考点考查了溶解度曲线及其应用,通过溶解度曲线我们可以获得很多信息;还考查了饱和溶液与不饱和溶液的转化等,本考点主要出现在选择题和填空题中.

练习册系列答案
相关题目
16.如图取用试剂的操作图示错误的是( )
| A. |  用药匙取用试剂 | B. |  用纸槽取用粉末 | C. |  倾倒液体 | D. |  取用块状固体 |
17.庆祝活动中,发生化学变化的是( )
| A. |  放鞭炮 | B. |  舞狮子 | C. |  抖箜築 | D. |  扭秧歌 |
18.下列叙述不符合化学知识的是( )
| A. | 皮蛋有碱性,食用时可加点醋中和 | |
| B. | 干冰升华未发生化学变化 | |
| C. | 消防队采用喷洒泡沫的方法进行油库灭火 | |
| D. | 水能变油(油主要含C、H元素的物质) |
15.下列实验操作不符合规范要求的是( )
| A. |  加热烧杯中液体 | B. |  放置洗净的试管 | ||
| C. |  锌粒放入试管 | D. |  嗅闻气体气味 |
6.在一次化学实验中,同学们将饱和硫酸铜溶液逐滴加到5mL饱和氢氧化钠溶液中,观察到以下异常实验现象:
写出硫酸铜溶液中存在的主要粒子的化学符号Cu2+、SO42-、H2O;
若蓝色沉淀是氢氧化铜,写出生成蓝色沉淀的化学方程式CuSO4+2NaOH=Na2SO4+Cu(OH)2↓.
【提出问题】实验①中蓝色沉淀为什么消失?
【查阅资料】
Ⅰ.氢氧化铜在室温下温度,70℃~80℃时分解生成氧化铜.
Ⅱ.铜酸钠[Na2Cu(OH)4]溶于水,溶液呈亮蓝色.
【猜想与假设】
Ⅰ.蓝色沉淀消失可能是氢氧化铜发生分解反应.
Ⅱ.蓝色沉淀消失可能是氢氧化铜溶解在氢氧化钠溶液中,形成亮蓝色溶液.
甲同学认为猜想Ⅰ不成立,理由是氢氧化铜分解生成黑色的氧化铜固体.
乙同学为验证猜想Ⅱ,进行了如下实验.
【进行实验】
【解释与结论】
(1)1号试管中现象为蓝色固体不消失.
(2)上述实验得出的结论是氢氧化铜能溶解在高于20%的NaOH溶液中形成亮蓝色溶液.
【反思与评价】
(1)进一步查阅资料可知,氢氧化铜在氢氧化钠溶液中溶解生成铜酸钠,反应的化学方程式为2NaOH+Cu(OH)2=Na2Cu(OH)4.
(2)丙同学推知饱和硫酸铜溶液与饱和氢氧化钠溶液的反应是放热反应,他依据的实验现象是蓝色沉淀逐渐变为黑色.
| 实验序号 | 滴加CuSO4溶液的量 | 实验现象 |
| ① | 第1~6滴 | 产生蓝色沉淀,但振荡后沉淀消失,形成亮蓝色溶液 |
| ② | 第7~9滴 | 产生蓝色沉淀,且沉淀逐渐增多.振荡后沉淀不消失,很快沉淀逐渐变成黑色 |
若蓝色沉淀是氢氧化铜,写出生成蓝色沉淀的化学方程式CuSO4+2NaOH=Na2SO4+Cu(OH)2↓.
【提出问题】实验①中蓝色沉淀为什么消失?
【查阅资料】
Ⅰ.氢氧化铜在室温下温度,70℃~80℃时分解生成氧化铜.
Ⅱ.铜酸钠[Na2Cu(OH)4]溶于水,溶液呈亮蓝色.
【猜想与假设】
Ⅰ.蓝色沉淀消失可能是氢氧化铜发生分解反应.
Ⅱ.蓝色沉淀消失可能是氢氧化铜溶解在氢氧化钠溶液中,形成亮蓝色溶液.
甲同学认为猜想Ⅰ不成立,理由是氢氧化铜分解生成黑色的氧化铜固体.
乙同学为验证猜想Ⅱ,进行了如下实验.
【进行实验】
| 实验操作 | 实验现象 |
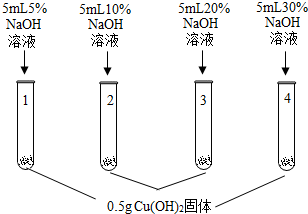 | 1号试管,… 2号试管,蓝色固体不消失 3号试管,蓝色固体减少 4号试管,蓝色固体消失,得到亮蓝色溶液 |
(1)1号试管中现象为蓝色固体不消失.
(2)上述实验得出的结论是氢氧化铜能溶解在高于20%的NaOH溶液中形成亮蓝色溶液.
【反思与评价】
(1)进一步查阅资料可知,氢氧化铜在氢氧化钠溶液中溶解生成铜酸钠,反应的化学方程式为2NaOH+Cu(OH)2=Na2Cu(OH)4.
(2)丙同学推知饱和硫酸铜溶液与饱和氢氧化钠溶液的反应是放热反应,他依据的实验现象是蓝色沉淀逐渐变为黑色.


 某学习小组用下列装置进行CO2的制取及性质探究实验.
某学习小组用下列装置进行CO2的制取及性质探究实验.