题目内容
4.通过晾晒海水或煮盐井水、盐湖水等,可以蒸发除去水分得到粗盐.粗盐中含有难溶性杂质(泥沙等)和多种可溶性杂质(氯化镁、氯化钙等).【提出问题】如何才能将粗盐中难溶性杂质和可溶性杂质(氯化镁、氯化钙)除去,从而获得较纯的食盐晶体
【实验方案】某同学为了提纯粗盐,设计了如下实验方案并进行实验.
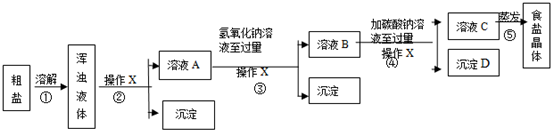
(1)实验步骤③和④的目的是除去粗盐中的易溶性杂质CaCl2,MgCl2.
(2)实验操作X的名称是过滤.
(3)实验步骤③的主要目的是2NaOH+MgCl2=Mg(OH)2↓+2NaCl (用化学方程式回答)
(4)判断氢氧化钠溶液已过量的方法是取反应后的溶液B少量,加入试管中,滴加酚酞试液,酚酞试液变红.
(5)实验步骤④中生成的沉淀D是碳酸钙.
(6)有同学认为原实验方案不完善,做出这种评价的依据是在除去MgCl2和CaCl2的同时,又引入了新的杂质NaOH和Na2CO3.
(7)为了完善原实验方案,你设计的实验是向溶液C中逐滴加入稀盐酸至不再产生气泡为止(仅写出实验操作和现象)
分析 (1)通过步骤③和④,可以除去粗盐中的易溶性杂质CaCl2、MgCl2;
(2)根据实验操作X可以将不溶性物质和溶液分离进行分析;
(3)根据氢氧化钠和氯化镁会生成氢氧化镁沉淀和氯化钠进行分析;
(4)这种方法不可行,因为MgCO3、Ca(OH)2均为微溶物,只用任意一种试剂就会有一种杂质生成微溶物而不能全部除去;
(5)根据碳酸钠和氯化钙会生成碳酸钙沉淀进行分析;
(6)根据在除去MgCl2和CaCl2时,加入的氢氧化钠、碳酸钠是过量的,除去氯化钙、氯化镁的同时,又引入了新的杂质NaOH和Na2CO3;
(7)根据盐酸会与氢氧化钠、碳酸钠反应生成氯化钠进行分析.
解答 解:(1)通过分析反应流程可知,步骤③和④,可以除去粗盐中的易溶性杂质CaCl2、MgCl2;
(2)实验操作X可以将不溶性物质和溶液分离,所以操作X的是过滤;
(3)氢氧化钠和氯化镁会生成氢氧化镁沉淀和氯化钠,化学方程式为:2NaOH+MgCl2=Mg(OH)2↓+2NaCl;
(4)这种方法不可行,因为MgCO3、Ca(OH)2均为微溶物,只用任意一种试剂就会有一种杂质生成微溶物而不能全部除去;
(5)碳酸钠和氯化钙会生成碳酸钙沉淀,所以实验步骤④中生成的沉淀D是碳酸钙;
(6)在除去MgCl2和CaCl2时,加入的氢氧化钠、碳酸钠是过量的,所以做出这种评价的依据是:在除去MgCl2和CaCl2的同时,又引入了新的杂质NaOH和Na2CO3;
(7)盐酸会与氢氧化钠、碳酸钠反应生成氯化钠,所以设计的实验是:向溶液C中逐滴加入稀盐酸至不再产生气泡,滴加酚酞试液时溶液不变色.
故答案为:(1)除去粗盐中的易溶性杂质CaCl2,MgCl2;
(2)过滤;
(3)MgCl2+NaOH=Mg(OH)2↓+2NaCl;
(4)取反应后的溶液B少量,加入试管中,滴加酚酞试液,酚酞试液变红;
(5)碳酸钙;
(6)在除去MgCl2和CaCl2的同时,又引入了新的杂质NaOH和Na2CO3;
(7)向溶液C中逐滴加入稀盐酸至不再产生气泡为止.
点评 本题涉及除杂、化学方程式的书写、反应进行情况的检验、复分解反应等方面的知识,比较难,是综合性题目.

| A. | 4个 | B. | 5个 | C. | 6个 | D. | 7个 |
| A. | 称取10.0g氯化钠,放入90ml水中,搅拌 | |
| B. | 称取10.0g生石灰,放入90ml水中,充分搅拌 | |
| C. | 量取10.0ml浓盐酸,放入90ml水中,搅拌 | |
| D. | 称取10.0g硫酸钡,放入90ml水中,充分搅拌 |
| A. |  向pH=13的氢氧化钠溶液中加入稀盐酸 | |
| B. |  向一定量的饱和的氯化钠溶液中加入氯化钠 | |
| C. |  等质量的锌粉和铁粉与足量的稀硫酸反应 | |
| D. |  向一定量Na2CO3和NaCl的混合溶液中滴加稀盐酸 |
| 加入稀硫酸 的质量/g | 9.6 | 9.8 | 9.9 | 10.0 | 10.1 |
| 溶液的pH | 12.4 | 12.1 | 11.8 | 7.0 | 2.2 |
(2)计算所测氢氧化钠溶液中溶质的质量分数.
| A. |  | B. |  | C. |  | D. |  |
 如图是某品牌巧克力的营养成分表,回答下列问题:
如图是某品牌巧克力的营养成分表,回答下列问题: