题目内容
19.如图是氧化沉淀法生产复印用Fe3O4粉的工艺流程图,根据要求回答问题.
(1)铁的另两种常见氧化物的化学式是Fe2O3、FeO.
(2)副产品P是硫酸钠,由溶液N获得该副产品的操作顺序是b→c→a(填序号).
a.过滤 b.加热浓缩 c.冷却结晶 d.晶体加热至完全失去结晶体
(3)通空气时的化学方程式是4Fe(OH)2+2H2O+O2═4Fe(OH)3,由沉淀M获得Fe3O4的过程中发生的反应为Fe(OH)2+2Fe(OH)3 $\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2O,控制“一定量空气”的目的是防止氢氧化亚铁全部被氧化为氢氧化铁.
沉淀M中Fe(OH)2和Fe(OH)3的最佳质量比为45:107.
分析 (1)根据常见的铁的氧化物来分析;
(2)根据氢氧化钠与硫酸亚铁反应的生成物来判断副产品,根据冷却热饱和溶液的过程考虑操作顺序;
(3)如果氧气过多会把氢氧化亚铁全部氧化,就得不到四氧化三铁了,根据方程式计算出Fe(OH)2和Fe(OH)3的相对分子质量比,别忘了前面的系数.
解答 解:(1)常见的铁的氧化物还有氧化铁和氧化亚铁,在氧化铁中,铁显+3价,氧化亚铁中铁显+2价,氧元素均为-2价,故填:Fe2O3;FeO;
(2)氢氧化钠与硫酸亚铁反应的生成物是氢氧化亚铁与硫酸钠,因为氢氧化亚铁属于另一反应的反应物了所以副产品是硫酸钠;冷却热饱和溶液 的过程是先加热,再降温,析出晶体后过滤再通过加热除去结晶水即可;
(3)通过反应Fe(OH)2+2Fe(OH)3?Fe3O4+4H2O可知,Fe(OH)2和Fe(OH)3都是反应物,如果不控制“一定量空气”氧气过多会把氢氧化亚铁全部氧化,就得不到四氧化三铁了;由化学方程式Fe(OH)2+2Fe(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2O可知,Fe(OH)2和Fe(OH)3的最佳质量比为:$\frac{90}{2×107}$=$\frac{45}{107}$.
故答案为:(1)Fe2O3;FeO;(2)硫酸钠,c,a;(3)防止氢氧化亚铁全部被氧化为氢氧化铁;45:107.
点评 通过回答本题知道了制取四氧化三铁的方法,溶解需要的仪器,由溶液析出晶体的方法.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.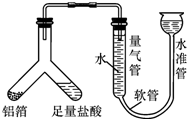 梧州市某中学化学兴趣小组的同学到超市购买锡纸用于烧烤,同学们看见商品标签上表明锡纸的材质为“铝箔”.
梧州市某中学化学兴趣小组的同学到超市购买锡纸用于烧烤,同学们看见商品标签上表明锡纸的材质为“铝箔”.
【提出问题】锡纸的材质到底是锡还是铝呢?小吴认为可以把锡纸放入盐酸中观察是否有气体放出来区别是锡还是铝,小周同学认为这样不能区别,理由是锡和铝都能与盐酸反应生成氢气.小施查阅资料发现锡的熔点为232℃,而铝的熔点为660℃,他用加热的方法区别出锡纸的材质是铝不是锡,接着同学们对铝这种金属进行探究.
【探究活动一】铝的含量分析
(1)小施用如图装置测定铝箔中金属铝的含量,检查该装置气密性的操作是从水准管一端注入水,待水准管和量气管出现较大高度差为止,静止几分钟,两侧高度差不缩小,证明装置气密性好.
(2)若测定进入量气管的气体体积为100mL(氢气的密度为0.09g/L),铝箔中金属铝的质量为0.081g(铝箔中只有铝能与盐酸反应生成气体).
【探究活动二】铝箔燃烧
同学们做铝箔燃烧的实验.小吴用坩埚钳夹持一小块铝箔放在酒精灯火焰上,轻轻晃动,观察到铝箔熔化,失去了光泽,但铝箔并不燃烧;小周另取一块铝箔,用砂纸仔细打磨,再用坩埚钳夹持放在酒精灯的火焰上,观察到铝箔仍不能燃烧.
(1)小施同学认为铝箔不能在空气中燃烧是因为铝与氧气反应生成一层致密的氧化铝薄膜附在铝的表面,阻止反应的进行,这也是铝箔抗腐蚀性强的原因.
(2)小施同学改进了实验,让铝箔燃烧并发出耀眼的白光,小施同学的实验方案是将铝箔卷曲,尖端夹一根火柴,将火柴引燃后,把火柴和铝箔一起伸入到盛有氧气的集气瓶中即可观察到铝箔燃烧并发出耀眼的白光.
【探究活动三】小吴将打磨后的铝片与铜盐溶液反应,现象如下:
(1)铝与氯化铜溶液反应的化学方程式为2Al+3CuCl2═2AlCl3+3Cu.
(2)对比两个实验,小周推测对铝与铜盐溶液的反应可能有促进作用的离子是Cl-(填离子符号),为了验证此推测,小施向实验一的CuSO4溶液中加入1gNaCl(填化学式)固体,立即观察到铝片上出现大量红色的铜.
 梧州市某中学化学兴趣小组的同学到超市购买锡纸用于烧烤,同学们看见商品标签上表明锡纸的材质为“铝箔”.
梧州市某中学化学兴趣小组的同学到超市购买锡纸用于烧烤,同学们看见商品标签上表明锡纸的材质为“铝箔”.【提出问题】锡纸的材质到底是锡还是铝呢?小吴认为可以把锡纸放入盐酸中观察是否有气体放出来区别是锡还是铝,小周同学认为这样不能区别,理由是锡和铝都能与盐酸反应生成氢气.小施查阅资料发现锡的熔点为232℃,而铝的熔点为660℃,他用加热的方法区别出锡纸的材质是铝不是锡,接着同学们对铝这种金属进行探究.
【探究活动一】铝的含量分析
(1)小施用如图装置测定铝箔中金属铝的含量,检查该装置气密性的操作是从水准管一端注入水,待水准管和量气管出现较大高度差为止,静止几分钟,两侧高度差不缩小,证明装置气密性好.
(2)若测定进入量气管的气体体积为100mL(氢气的密度为0.09g/L),铝箔中金属铝的质量为0.081g(铝箔中只有铝能与盐酸反应生成气体).
【探究活动二】铝箔燃烧
同学们做铝箔燃烧的实验.小吴用坩埚钳夹持一小块铝箔放在酒精灯火焰上,轻轻晃动,观察到铝箔熔化,失去了光泽,但铝箔并不燃烧;小周另取一块铝箔,用砂纸仔细打磨,再用坩埚钳夹持放在酒精灯的火焰上,观察到铝箔仍不能燃烧.
(1)小施同学认为铝箔不能在空气中燃烧是因为铝与氧气反应生成一层致密的氧化铝薄膜附在铝的表面,阻止反应的进行,这也是铝箔抗腐蚀性强的原因.
(2)小施同学改进了实验,让铝箔燃烧并发出耀眼的白光,小施同学的实验方案是将铝箔卷曲,尖端夹一根火柴,将火柴引燃后,把火柴和铝箔一起伸入到盛有氧气的集气瓶中即可观察到铝箔燃烧并发出耀眼的白光.
【探究活动三】小吴将打磨后的铝片与铜盐溶液反应,现象如下:
| 实验一:4mL8%CuSO4溶液 | 实验二:4mL8%CuCl2溶液 | |
| 实验 现象 | 短时间内无变化,一段时间后铝片上才出现少量红色的铜 | 铝片上迅速有红色的铜出现 |
(2)对比两个实验,小周推测对铝与铜盐溶液的反应可能有促进作用的离子是Cl-(填离子符号),为了验证此推测,小施向实验一的CuSO4溶液中加入1gNaCl(填化学式)固体,立即观察到铝片上出现大量红色的铜.
11.区分如表各组物质所用的两种方法都正确的是( )
| 选项 | 需区分的物质 | 方法一 | 方法二 |
| A | 氮气和二氧化碳 | 分别通入澄清石灰水 | 分别通入石蕊溶液 |
| B | 碳酸钠溶液与硫酸钠溶液 | 加硝酸钡溶液 | 加稀盐酸 |
| C | 碳酸氢铵与硫酸钾 | 取样品闻气味 | 观察颜色 |
| D | 棉布与涤纶布 | 取样品点燃闻气味 | 观察颜色 |
| A. | A | B. | B | C. | C | D. | D |
 如图所示是木炭还原氧化铜的实验,写出该反应的化学方程式:C+2CuO$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2 ↑.实验完毕后,发现试管内仍有黑色固体物质存在,其中网罩的作用是提高温度.澄清石灰水的作用是验证反应是否产生二氧化碳.
如图所示是木炭还原氧化铜的实验,写出该反应的化学方程式:C+2CuO$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2 ↑.实验完毕后,发现试管内仍有黑色固体物质存在,其中网罩的作用是提高温度.澄清石灰水的作用是验证反应是否产生二氧化碳. 在学校的元旦联欢会上,某同学表演了“水能生火”的魔术.首先他将少量超氧化钾(KO2)粉末用脱脂棉包裹,没有任何变化(已知脱脂棉与超氧化钾不反应),然后向包有超氧化钾(KO2)粉末的脱脂棉上滴加少量的水,则脱脂棉迅速发生剧烈的燃烧(比在空气中燃烧还剧烈).小冬对此很感兴趣,于是,他和同学们进行探究.请你也参与他们的本次探究活动.
在学校的元旦联欢会上,某同学表演了“水能生火”的魔术.首先他将少量超氧化钾(KO2)粉末用脱脂棉包裹,没有任何变化(已知脱脂棉与超氧化钾不反应),然后向包有超氧化钾(KO2)粉末的脱脂棉上滴加少量的水,则脱脂棉迅速发生剧烈的燃烧(比在空气中燃烧还剧烈).小冬对此很感兴趣,于是,他和同学们进行探究.请你也参与他们的本次探究活动. 如图是电解水中,分子分解过程示意图.你能得出的规律和结论.
如图是电解水中,分子分解过程示意图.你能得出的规律和结论.