题目内容
4.质量守恒定律是一切化学变化都必须遵循的一个重要定律,对于我们对化学变化的定性研究和定量研究都有着极其重要的指导作用.(1)定性研究:在实验室中,不能用带磨口玻璃塞的玻璃试剂瓶盛装氢氧化钠溶液,因为氢氧化钠会与玻璃成分中的某种物质X发生化学反应,使玻璃塞和玻璃试剂瓶口粘连在一起.其反应的化学方程式为X+2NaOH═Na2SiO3+H2O,则X的化学式为SiO2.
(2)定量研究:酒精是乙醇的俗称,可用于医疗消毒,也常作燃料.在氧气充足的条件下完全燃烧的生成物为二氧化碳和水,现将一定质量的乙醇和氧气放在密闭容器中,它们恰好完全燃烧,测得反应前后各物质的质量如表所示.请答题:
| 物质质量 | 乙醇 | 氧气 | 二氧化碳 | 水 |
| 反应前/g | 4.6 | a | 0 | 0 |
| 反应后/g | 0 | 0 | 8.8 | 5.4 |
②生成物中,二氧化碳中碳元素的质量为2.4g,水中氢元素的质量为0.6g;
③由于氧气只含氧元素,故生成物中的碳元素和氢元素都来自于反应物中的乙醇,结合上面的计算结果可知,乙醇中一定含有(选填“含有”或“不含有”)氧元素,其质量为1.6g,乙醇所含碳、氢、氧元素的质量比为12:3:8,原子个数比为2:6:1.
分析 (1)由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断生成物X的化学式.
(2)根据质量守恒定律和有关化学式的计算知识进行分析.
解答 解:(1)根据反应的化学方程式X+2NaOH═Na2SiO3+H2O,反应物中O、Na、H原子个数分别为2、2、2,反应后的生成物中Si、O、Na、H原子个数分别为1、4、2、2,根据反应前后原子种类、数目不变,则每个X分子由2个O原子和1个Si原子构成,则物质X的化学式为SiO2.
(2)①根据质量守恒定律可知,a=8.8+5.4-4.6=9.6;
②生成物中,二氧化碳中碳元素的质量为8.8g×$\frac{12}{44}$=2.4g,水中氢元素的质量为5.6g×$\frac{2}{18}$=0.6g;
③由于氧气只含氧元素,故生成物中的碳元素和氢元素都来自于反应物中的乙醇,2.4g+0.6g<4.6g,因此乙醇中一定含有氧元素,其质量为4.6g-2.4g-0.6g=1.6g,乙醇所含碳、氢、氧元素的质量比为2.4g:0.6g:1.6g=12:3:8,原子个数比为$\frac{12}{12}$:$\frac{3}{1}$:$\frac{8}{16}$=2:6:1.
故填:(1)SiO2;(2)①9.6;②2.4g;0.6g;③乙醇;含有;1.6g;12:3:8;2:6:1.
点评 本题难度不大,利用化学反应前后元素守恒、原子守恒来确定物质的化学式是解题的关键.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
8.打开装有浓氨水的试剂瓶,能闻到刺激性气味,从分子的角度解释正确的是( )
| A. | 分子大小可以改变 | B. | 分子由原子构成 | ||
| C. | 分子在不断运动 | D. | 分子可以保持物质的化学性质 |
5.分析推理是一种重要的化学思维方法.下列推理正确的是( )
| A. | 分子、原子可以构成物质,所以物质一定是由分子、原子构成的 | |
| B. | 碱性溶液能使酚酞试液变红色,所以能使酚酞试液变红色的溶液的pH一定大于7 | |
| C. | 溶液的特征是均一、稳定,所以均一、稳定的液体一定是溶液 | |
| D. | 稀有气体元素的原子最外层有8个(氦是2个)电子,所以微粒 一定是稀有气体元素的原子 一定是稀有气体元素的原子 |
9.下列溶液中,pH大于7的是( )
| A. | 稀氢氧化钠溶液 | B. | 稀盐酸 | C. | 氯化钠溶液 | D. | 稀硫酸 |
 如图是X、Y、Z三种固体物质的溶解度曲线,请回答下列问题:
如图是X、Y、Z三种固体物质的溶解度曲线,请回答下列问题: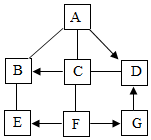 已知A~G是初中化学常见的物质,A、B、C、E、F属于不同类别的物质,G溶液呈 黄色,A与C反应产生白色沉淀(微溶物不列为沉淀),它们相互间发生反应或转化 的关系如图所示(“-”表示两种物质间能发生反应,“→”表示两种物质间的转化 关系,部分反应物、生成物和反应条件已经略去).
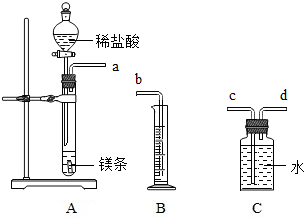
已知A~G是初中化学常见的物质,A、B、C、E、F属于不同类别的物质,G溶液呈 黄色,A与C反应产生白色沉淀(微溶物不列为沉淀),它们相互间发生反应或转化 的关系如图所示(“-”表示两种物质间能发生反应,“→”表示两种物质间的转化 关系,部分反应物、生成物和反应条件已经略去). 利用如图所示实验装置制备常见气体,请回答有关问题
利用如图所示实验装置制备常见气体,请回答有关问题