题目内容
6.下列离子能在pH=11的溶液中大量共存的是( )| A. | CO32- K+ Cl- Ca2+ | B. | K+ NO3- Na+ OH- | ||
| C. | H+ Ba2+ Cl- SO42- | D. | K+ OH- SO42- Cu2+ |
分析 pH为11的水溶液显碱性,水溶液中含有大量的OH-.根据复分解反应的条件,离子间若能互相结合成沉淀、气体或水,则离子不能共存,据此进行分析判断即可.
解答 解:pH为11的水溶液显碱性,水溶液中含有大量的OH-.
A、CO32-、Ca2+两种离子能结合成碳酸钙沉淀,不能在碱性溶液中大量共存,故选项错误;
B、四种离子间不能结合成沉淀、气体或水,能在碱性溶液中大量共存,故选项正确;
C、Ba2+、SO42-两种离子能结合成硫酸钡沉淀,H+与碱性溶液中的OH-能结合成水,在碱性溶液中不能大量共存,故选项错误;
D、Cu2+、OH-两种离子能结合成氢氧化铜沉淀,不能在碱性溶液中大量共存,故选项错误;
故选:B.
点评 本题考查了离子共存的问题,判断各离子在溶液中能否共存,主要看溶液中的各离子之间能否发生反应生成沉淀、气体、水;还要注意是在碱性溶液中共存.

练习册系列答案
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
2.下列图示实验操作中,不正确的是( )
| A. |  闻药品的气味 | B. |  称量NaOH固体 | C. |  蒸发食盐水 | D. |  稀释浓硫酸 |
3.下面是某小组同学探究实验室制取二氧化碳的反应原理的过程.
【查阅资料】a.碳酸盐与酸在常温下反应可得到二氧化碳;
b.碳酸氢铵受热分解NH4HCO3(固)$\frac{\underline{\;\;△\;\;}}{\;}$NH3+CO2↑+H2O
【讨论】(1)小静认为用碳酸氢铵受热分解制取二氧化碳不合适,理由是碳酸氢铵受热分解产生产生多种气体,使制取的二氧化碳不纯
(2)小欣认为碳酸盐与酸反应,所用的酸不宜选浓盐酸的原因是因浓盐酸挥具有挥发性,使收集到的二氧化碳不纯
【提出问题】选择哪种碳酸盐与酸的反应制二氧化碳合适?
小组的同学用碳酸钠粉末、块状大理石、稀盐酸、稀硫酸这些药品,探究适合实验室制二氧化碳的药品.
【实验与结论】
(1)根据探究结论,实验室制取二氧化碳的反应原理为CaCO3+2HCl═CaCl2+H2O+CO2↑
(用化学方程式表示)
(2)实验室制二氧化碳的发生装置还可用于制取氧气,制取氧气的药品是H2O2、MnO2(填药品的化学式)
【查阅资料】a.碳酸盐与酸在常温下反应可得到二氧化碳;
b.碳酸氢铵受热分解NH4HCO3(固)$\frac{\underline{\;\;△\;\;}}{\;}$NH3+CO2↑+H2O
【讨论】(1)小静认为用碳酸氢铵受热分解制取二氧化碳不合适,理由是碳酸氢铵受热分解产生产生多种气体,使制取的二氧化碳不纯
(2)小欣认为碳酸盐与酸反应,所用的酸不宜选浓盐酸的原因是因浓盐酸挥具有挥发性,使收集到的二氧化碳不纯
【提出问题】选择哪种碳酸盐与酸的反应制二氧化碳合适?
小组的同学用碳酸钠粉末、块状大理石、稀盐酸、稀硫酸这些药品,探究适合实验室制二氧化碳的药品.
【实验与结论】
| 实验内容 | 实验现象 | 结论 |
 | 剧烈反应,迅速放出大量气泡 | 反应速率过快,气体不便收集,不宜实验室制取二氧化碳 |
 | 产生气泡,速率迅速减慢,反应几乎停止 | 无法持续产生二氧化碳,不能用于实验室制取二氧化碳 |
 | 产生大量气泡 | 反应速率适中,气体便于收集,适宜实验室制取二氧化碳 |
(用化学方程式表示)
(2)实验室制二氧化碳的发生装置还可用于制取氧气,制取氧气的药品是H2O2、MnO2(填药品的化学式)
14.下列关于稀有气体的叙述中不正确的是( )
| A. | 在通电时一般都能发出有色光 | B. | 都是无色无味的气体 | ||
| C. | 一定不能和其他物质反应 | D. | 是空气中含量最少的气体 |
18.菜单“无鸡鸭亦可无鱼肉亦可青菜一碟足以”是一个经典笑话.标点断句不同,吃到的食物就会不同,无论采用哪种断句方式,从均衡营养的角度分析,你认为一定还要补充的是( )
| A. |  馒头 | B. |  红烧排骨 | C. |  胡萝卜 | D. |  桔子 |
16.工业用盐亚硝酸钠(NaNO2)有毒,其外观与食盐极为相似,其氮元素的化合价为( )
| A. | +1 | B. | +2 | C. | +3 | D. | +4 |
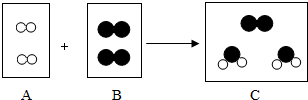 在宏观、微观和符号之间建立联系,是化不学科的特点.如图是某化学反应的微观过程示意图(“
在宏观、微观和符号之间建立联系,是化不学科的特点.如图是某化学反应的微观过程示意图(“ ”表示氧原子,“
”表示氧原子,“ ”表示氢原子).
”表示氢原子). 金属是重要的资源,在日常生活中已得到越来越广泛的应用,如图,向一定量AgNO3溶液中加入铜和锌的混合粉末,充分反应过滤,得溶液甲和固体乙.
金属是重要的资源,在日常生活中已得到越来越广泛的应用,如图,向一定量AgNO3溶液中加入铜和锌的混合粉末,充分反应过滤,得溶液甲和固体乙. 新华网东京4月10日电,截至当地时间当日19时,3月11日发生的日本大地震及其引发的海啸已确认造成13013人死亡、14608人失踪,给日本乃至全球的经济带来沉重打击.
新华网东京4月10日电,截至当地时间当日19时,3月11日发生的日本大地震及其引发的海啸已确认造成13013人死亡、14608人失踪,给日本乃至全球的经济带来沉重打击.