题目内容
2.某无色溶液可能由硫酸、氢氧化钠溶液、氯化钠溶液、碳酸钠溶液中的一种或几种混合而成.为了分析无色溶液的成分,取少量该无色溶液进行实验,实验方案设计如图甲:
(1)该无色溶液中一定含有Na2CO3(填化学式,下同),一定没有H2SO4.
(2)写出实验步骤①?中一定发生的反应化学方程式Na2CO3+2HCl═2NaCl+H2O+CO2↑.
(3)若修改步骤?①中加入的试剂,其它过程和现象不变即可确定一种可能含有物质的存在,步骤①?修改后应加入的试剂是稀硝酸.
(4)如图乙案是证明另一种可能含有物质存在的实验片段:试剂X是CaCl2溶液,溶液D是红色.
(5)实验步骤?②和?③都有相同的实验操作,该操作的名称是过滤.
分析 根据碳酸钠能和酸反应生成气体,“无色溶液可能由硫酸、氢氧化钠溶液、氯化钠溶液、碳酸钠溶液中的一种”,加适量稀盐酸有气体生成,则推测一定有碳酸钠,则一定没有硫酸,因为二者不能共存;而与硝酸银反应有不溶于硝酸的沉淀生成,则一定含有氯离子,则可推测可能含有的物质.要仔细分析每一实验步骤的用意及实验中所发生的化学反应,从而做出正确的判断.
解答 解:(1)取无色溶液少量,滴加过量稀盐酸溶液,有气体生成,则推测一定有碳酸钠;硫酸与碳酸钠反应,二者不能共存,故一定没有硫酸;向所得无色滤液中加入足量稀硝酸和硝酸银溶液,产生白色沉淀,说明滤液中含有氯离子,由于碳酸钠和稀盐酸反应生成氯化钠,无法确定原溶液中是否含有氯化钠;通过上述实验和现象,还无法确定是否含有氢氧化钠;
要证明氯化钠存在,可取无色溶液少许,加足量稀硝酸充分反应,滴加硝酸银溶液,若仍有沉淀生成,说明含有氯化钠;要证明氢氧化钠是否存在,可取无色溶液少许,加足量氯化钡或氯化钙溶液充分反应,静置,向上层清液中滴加酚酞试液,若溶液变红,则含有氢氧化钠;
(2)实验步骤①中碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳,化学方程式为:Na2CO3+2HCl═2NaCl+H2O+CO2↑;
(3)若修改步骤?中加入的试剂,其它过程和现象不变即可确定一种可能含有物质的存在,在无色溶液B应加入的试剂是稀硝酸,故结果生成白色沉淀氯化银,可以确定溶液中氯化钠的存在;
(4)为了验证可能存在氢氧化钠,则推测试剂X是氯化钙溶液,除去碳酸钠,当溶液D仍然显红色时,即可确定氢氧化钠的存在;
(5)分离可溶和不可溶物质的操作为过滤.
故答案为:(1)Na2CO3,H2SO4;
(2)Na2CO3+2HCl═2NaCl+H2O+CO2↑;
(3)稀硝酸;
(4)CaCl2,红;
(5)过滤.
点评 本题为文字叙述型推断题,掌握常见物质的性质,通过题目给出的信息,在比较鉴别的基础上,得出正确的实验结论,解答时要熟练掌握盐的水溶性,及物质之间的反应,通过实验现象推出物质的组成.

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案| A. | 灼烧闻气味:羊毛与棉线 | |
| B. | 加水溶解测溶液温度:硝酸铵固体和氢氧化钠固体 | |
| C. | 观察物体颜色:木炭粉与二氧化锰 | |
| D. | 滴加石蕊试液观察颜色:稀盐酸和食盐水 |
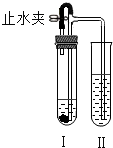 如图所示装置进行实验(图中铁架台等仪器均己略去).在Ⅰ中加入试剂后,塞紧橡皮塞,立即打开止水夹,Ⅱ中有气泡冒出;一段时间后关闭止水夹,Ⅱ中液面上升,溶液由无色变为浑浊.符合以上实验现象的Ⅰ和Ⅱ中应加入的试剂是( )
如图所示装置进行实验(图中铁架台等仪器均己略去).在Ⅰ中加入试剂后,塞紧橡皮塞,立即打开止水夹,Ⅱ中有气泡冒出;一段时间后关闭止水夹,Ⅱ中液面上升,溶液由无色变为浑浊.符合以上实验现象的Ⅰ和Ⅱ中应加入的试剂是( )| Ⅰ | Ⅱ | |
| A | CaCO3、稀HCl | KNO3 |
| B | Na2CO3、稀H2SO4 | NaCl |
| C | Zn、稀H2SO4 | BaCl2 |
| D | Cu、稀H2SO4 | Ba(OH)2 |
| A. | A | B. | B | C. | C | D. | D |
| 第一次 | 第二次 | 第三次 | |
| 稀盐酸质量/g | 50 | 50 | 50 |
| 烧杯内剩余物质总质量/g | 63.8 | 111.6 | 161.6 |
(2)所取样品中碳酸钙质量10g,则样品中钙元素质量分数为25%.
(3)所用稀盐酸的溶质质量分数.
| A. | 浓硫酸常用作干燥剂,如湿润的NH3可以用浓硫酸来干燥 | |
| B. | 石灰浆能用来粉刷墙壁是因为石灰浆中的CaO可以和空气中的CO2反应 | |
| C. | 波尔多液是一种农药,可以用铁桶来配制 | |
| D. | 二氧化碳能灭火既利用了其化学性质又利用了其物理性质 |
| A. | 将试纸直接浸没在溶液中,测定某溶液的pH | |
| B. | 过滤时,漏斗下端的尖嘴部分需紧贴烧杯内壁 | |
| C. | 未说明药品用量时,一般液体取5毫升左右 | |
| D. | 将氢氧化钠固体放在衬有纸片的托盘上称量 |
 水是生命之源、生产之要、生态之基.
水是生命之源、生产之要、生态之基. B、
B、 C、
C、 D、
D、
