题目内容
12.经过一年的化学学习,我们对“酸、碱、盐”有了一定的.认识:(1)溶于水时放出大量热,且能做干燥剂的碱是氢氧化钠
(2)工业上常选用氢氧化钙来中和酸性污水的原因是氢氧化钙价格低廉 (任答一条即可);炉具清洁剂中常含有氢氧化钠以清除油污,此过程属于化学(填“物理”或“化学”)变化.
(3)氢氧化钙、氢氧化钠均需要密闭保存,请用方程式表示氢氧化钠密闭保存的原因CO2+2NaOH=Na2CO3+H2O
(4)兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行如下实验.

若A是Ba(OH)2溶液,现象a有白色沉淀,现象b为无色酚酞试液变红色,该实验不能
(填“能”或“不能”)说明样品中有NaOH和Na2O3,你的理由是因为氢氧化钡与碳酸钠反应生成的氢氧化钠也会使酚酞试液变红,无法证明原物质中是否含有氢氧化钠
(5 )取20g部分变质的氢氧化钠样加水配制成溶液,向上k溶液中加人足量的氢氧化钡溶液,生成沉淀为9.85g,计算该样品中所含杂质的质量分数(结果精确到0.1%).
(6)认识物质要一分为二.请举出二氧化碳在生产和生活中利与弊,(各举一条即可).
分析 (1)溶于水放出大量热的物质有氢氧化钠和浓硫酸等;
(2)从性质和价格、环保等上分析用途;氢氧化钠以清除油污利用化学原理.
(3)氢氧化钠固体易吸水潮解,能与空气中的二氧化碳反应,据此解答.
(4)根据氢氧化钡与碳酸钠反应生成的氢氧化钠也会使酚酞试液变红分析.
(5)根据氢氧化钠的用途分析.
解答 解:(1)溶于水放出大量热的物质有氢氧化钠和浓硫酸等,属于碱的是氢氧化钠;
(2)氢氧化钙既有碱性并且价格低廉,氢氧化钙微溶于水,不会形成二次污染等工业上常选用氢氧化钙来中和酸性污水;氢氧化钠以清除油污利用化学原理.
(3)氢氧化钠固体易吸水潮解,能与空气中的二氧化碳反应而变质,所以实验室固体药品氢氧化钠必须密闭保存,方程式为:CO2+2NaOH=Na2CO3+H2O.
(4)氢氧化钡能与碳酸钠反应生成碳酸钡沉淀和氢氧化钠,生成的氢氧化钠能使酚酞试液变红,故不能确定原固体中是否含有氢氧化钠;
(5)解:该20g样品中含杂质Na2CO3的质量为x
Ba(OH)2+Na2CO3=BaCO3↓+2NaOH
106 197
x 9.85g
$\frac{106}{x}$=$\frac{197}{9.85g}$
x=5.3g
该样品中Na2CO3的质量分数为:$\frac{5.3g}{20g}$×100%=26.5%
答:该样品中Na2CO3的质量分数是26.5%.
(6)利用二氧化碳可用于灭火等.但是过多排放加重了温室效应.
故答案为:(1)氢氧化钠
(2)氢氧化钙价格低廉 或 氢氧化钙微溶于水,不会形成二次污染等合理即可;化学
(3)CO2+2NaOH=Na2CO3+H2O
(4)不能,因为氢氧化钡与碳酸钠反应生成的氢氧化钠也会使酚酞试液变红,无法证明原物质中是否含有氢氧化钠.
(5)26.5%;
(6)利:可用于灭火.弊:过多排放加重了温室效应(合理即可)
点评 主要考查了碱的化学性质、保存相关的知识,培养学生的应用知识的能力.

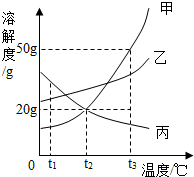 图是甲、乙、丙三种固体物质的溶解度曲线.下列叙述错误的是( )
图是甲、乙、丙三种固体物质的溶解度曲线.下列叙述错误的是( )| A. | t1℃时,三种物质的溶解度大小顺序为:丙>乙>甲 | |
| B. | 升高温度可以将接近饱和的丙溶液变为饱和溶液 | |
| C. | t3℃的甲、丙两物质的饱和溶液降温到t2℃时,所得溶液的溶质质量分数相等 | |
| D. | t2℃时,50g水中加入15g甲物质,所得溶液的溶质质量分数约为16.7% |
| A. | N4的摩尔质量是56g | |
| B. | N4与N2互为同素异形体 | |
| C. | N4与N2稳定 | |
| D. | 等物质的量的N4与N2所含分子个数比为2:1 |
| A. | 蒸馏水 | B. | 汞 | C. | 氯化钠 | D. | 氧气 |

 豆腐是生活中常见的食品,主要成分如右图所示.
豆腐是生活中常见的食品,主要成分如右图所示. 腐可以补充人体每天所需的钙元素,缺钙会导致的疾病是C(填字母序号).
腐可以补充人体每天所需的钙元素,缺钙会导致的疾病是C(填字母序号).