题目内容
1.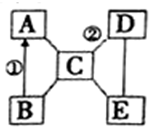 A、B、C、D、E是初中化学常见的五种不同类别的物质,其中B为红色固体,C是胃液的主要成分,E俗称苏打.图中“-”表示两端的物质间能发生化学反应,“→”表示物质间存在转化关系,部分反应物、生成物及反应条件已略去.
A、B、C、D、E是初中化学常见的五种不同类别的物质,其中B为红色固体,C是胃液的主要成分,E俗称苏打.图中“-”表示两端的物质间能发生化学反应,“→”表示物质间存在转化关系,部分反应物、生成物及反应条件已略去.请回答下列问题:
(1)写出下列物质的化学式:AFe;ENa2CO3.
(2)写出①、②反应的化学方程式:
①3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 ②Ca(OH)2+2HCl=CaCl2+2H2O
(3)C与E反应的基本反应类型为复分解反应.
分析 根据A、B、C、D、E是初中化学常见的五种不同类别的物质,根据“C是胃液的主要成分”,所以C是盐酸,B为红色固体,B和盐酸会发生反应,所以B是氧化铁,氧化铁会转化成A,A和盐酸会发生反应,所以A是铁,E广泛用于玻璃、造纸、纺织和洗涤剂的生产等,E和盐酸会发生反应,“E俗称苏打”,所以E是碳酸钠,D和盐酸、碳酸钠会反应,所以D是碱,D可以是氢氧化钙,然后将推出的各种物质代入转化关系中验证即可.
解答 解:(1)A、B、C、D、E是初中化学常见的五种不同类别的物质,根据“C是胃液的主要成分”,所以C是盐酸,B为红色固体,B和盐酸会发生反应,所以B是氧化铁,氧化铁会转化成A,A和盐酸会发生反应,所以A是铁,E广泛用于玻璃、造纸、纺织和洗涤剂的生产等,E和盐酸会发生反应,“E俗称苏打”,所以E是碳酸钠,D和盐酸、碳酸钠会反应,所以D是碱,D可以是氢氧化钙,经过验证,推出的各种物质均满足题意,推导正确,所以A是Fe,E是Na2CO3;
(2)反应①是氧化铁和一氧化碳在高温的条件下反应生成铁和二氧化碳,化学方程式为:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
反应②是氢氧化钙和盐酸反应生成氯化钙和水,化学方程式为:Ca(OH)2+2HCl=CaCl2+2H2O;
(3)C与E的反应是盐酸和碳酸钠反应生成氯化钠和水及二氧化碳,满足复分解反应的条件,所以该反应属于复分解反应.
故答案为:
(1)Fe,Na2CO3;
(2)3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;Ca(OH)2+2HCl=CaCl2+2H2O;
(3)复分解反应.
点评 在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可.

 阅读快车系列答案
阅读快车系列答案| A. | 加热液体时,液体体积不能超过试管容积的三分之一 | |
| B. | 将试管夹从试管底部往上套,夹在试管的中上部 | |
| C. | 振荡试管时.用手紧握试管,拇指堵住试管口,上下晃动 | |
| D. | 滴加液体时,滴瓶滴管的尖端不能触及已加过其它试剂的试管内壁 |
| 现象 | 结论 |
| 溶液呈蓝色,有黑色不溶物 | 含CuO、C |
| 溶液颜色无明显变化,有黑色不溶物 | 只含C |

①试管a中的化学方程式为C+2CuO$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑.
②最能说明a试管中氧化铜和碳已完全反应的实验现象是b中的导管口不再产生气泡.
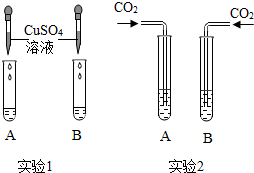 氢氧化钠和氢氧化钙是两种常见的碱.甲同学将两种碱的溶液分别装入试管A、B,并进行了如图所示的二组实验.
氢氧化钠和氢氧化钙是两种常见的碱.甲同学将两种碱的溶液分别装入试管A、B,并进行了如图所示的二组实验.①实验1中,若B中是NaOH溶液,滴加硫酸铜溶液静置后得到蓝色不溶物和无色清液,则清液中溶质的成分是Na2SO4、可能有NaOH(用化学式表示).
②实验2中,甲同学向两支试管中分别通入适量的二氧化碳,A(氢氧化钙溶液)中有白色沉淀生成,发生反应的化学方程式为Ca(OH)2+CO2=CaCO3↓+H2O,B(氢氧化钠溶液)中无明显现象.
③为了探究实验2中二氧化碳是否与氢氧化钠反应,甲同学又设计了如下对比实验:
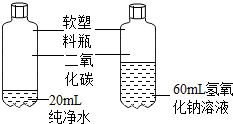 | 乙同学认为该实验设计不符合对比实验的基本 原则,理由是变量不唯一. |
【提出猜想】猜想1:溶质只有氢氧化钠
猜想2:溶质只有碳酸钠
猜想3:溶质有氢氧化钠和碳酸钠
…
【实验探究】
| 实 验 操 作 | 实验现象 | 结 论 |
| I.取B中少量溶液于试管中,加入足量澄清石灰水. II.静置后,取上层清液,向其中加几滴酚酞试液. | 产生白色沉淀、溶液呈红色 | 猜想3成立 |
老师评价丙同学得出的结论不正确,原因是操作Ⅰ中碳酸钠与氢氧化钙反应生成了NaOH,会对判断该溶质中是否含有NaOH造成干扰;
为了使“猜想3成立”,丙同学对上述“实验探究”进行了改动,他的做法是将操作1中的澄清石灰水改为氯化钡.
| A. | K3PO4 | B. | NH4Cl | C. | K2CO3 | D. | Ca(H2PO4)2 |
| A. |  铁制圆规 | B. |  铅笔芯 | C. |  纯棉笔袋 | D. |  塑料笔套 |
| A. | 植树造林 | B. | 无纸化办公 | C. | 随意焚烧垃圾 | D. | 绿色出行 |
 同学们在实验室用10%的稀盐酸和石灰石制取二氧化碳并进行二氧化碳性质实验.
同学们在实验室用10%的稀盐酸和石灰石制取二氧化碳并进行二氧化碳性质实验. 如图为几种固体的溶解度曲线,回答下列问题:
如图为几种固体的溶解度曲线,回答下列问题: