题目内容
12.一包黑色粉末可能是由氧化铜和碳粉中的一种或两种物质组成,某学校科学小组为确定其成分取少量该黑色粉末于烧杯中,加入过量稀硫酸,充分搅拌后观察.下表是实验中可能出现的现象与对应结论,请你填写下表中空白处的相关内容:| 现象 | 结论 |
| 溶液呈蓝色,有黑色不溶物 | 含CuO、C |
| 溶液颜色无明显变化,有黑色不溶物 | 只含C |

①试管a中的化学方程式为C+2CuO$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑.
②最能说明a试管中氧化铜和碳已完全反应的实验现象是b中的导管口不再产生气泡.
分析 氧化铜与硫酸可反应生成蓝色的硫酸铜溶液和水,碳和硫酸不反应,据此并结合实验结论、实验现象进行分析;
①碳和氧化铜高温生成铜和二氧化碳,据此书写方程式;
②该反应生成二氧化碳,所以可据b中导管口是否产生气泡判断是否完全反应.
解答 解:取少量该黑色粉末于烧杯中,加入过量稀硫酸,若粉末中含有CuO、C,则烧杯内氧化铜与硫酸反应生成硫酸铜溶液,溶液变蓝,碳与硫酸不反应,所以烧杯内还会有黑色不溶物;若溶液颜色无变化,有黑色不溶物,说明黑色粉末中无氧化铜,只有碳;
①碳和氧化铜高温生成铜和二氧化碳,方程式是C+2CuO $\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑;
②该反应生成二氧化碳,所以可据b中导管口是否产生气泡判断是否完全反应;
故答案为:
| 现象 | 结论 |
| 溶液呈蓝色,有黑色不溶物 | 含CuO、C |
| 溶液颜色无明显变化,有黑色不溶物 | 只含 C |
点评 本题考查了有关碳的实验探究,了解二氧化碳的性质、氧化铜和硫酸、碳和氧化铜反应实验等知识,才能结合题意正确分析解答.

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
17.小组在用盐酸和大理石制取二氧化碳时,发现产生气泡的速率不一样,同学们展开了探究.所用盐酸浓度为10%、20%,大理石有细颗粒与粗颗粒两种规格,实验温度为20℃、30℃,每次实验盐酸的用量为100mL、大理石用量为10.0g.
【提出问题】盐酸与大理石反应的快慢受哪些因素的影响呢?
【猜想与假设】a.可能与盐酸浓度有关;b.可能与温度有关;c.可能与大理石规格有关
【设计并实验】
(1)请完成以下实验设计表,并在实验目的一栏中填写对应的实验编号.
(2)请写出大理石与盐酸反应的化学方程式CaCO3+2HCl=CaCl2+H2O+CO2↑;
【数据整理】
实验①中CO2质量随时间变化的关系如图.

【分析数据】
(3)以上图形中有四条曲线,其中实验③对应的曲线为B,即③-B.请写出能反映其它三组实验对应的曲线④-A,①-C,②-D.
【拓展】
(4)以上方法是通过测量产生气体快慢来判断化学反应的快慢,还可以借助其它反应现象来判断反应的快慢,你认为是固体减少的快慢.
【提出问题】盐酸与大理石反应的快慢受哪些因素的影响呢?
【猜想与假设】a.可能与盐酸浓度有关;b.可能与温度有关;c.可能与大理石规格有关
【设计并实验】
(1)请完成以下实验设计表,并在实验目的一栏中填写对应的实验编号.
| 实验 编号 | 温度(℃) | 大理石 规格 | 盐酸浓度(均取100mL) | 实验目的 |
| ① | 20 | 粗颗粒 | 20% | (Ⅰ)实验①和②探究盐酸浓度对该反应速率的影响; (Ⅱ)实验①和④探究温度对该反应速率的影响; (Ⅲ)实验①和③探究大理石规格(粗、细)对该反应速率的影响; |
| ② | 20 | 粗颗粒 | 10% | |
| ③ | 细颗粒 | 20% | ||
| ④ | 粗颗粒 |
【数据整理】
实验①中CO2质量随时间变化的关系如图.

【分析数据】
(3)以上图形中有四条曲线,其中实验③对应的曲线为B,即③-B.请写出能反映其它三组实验对应的曲线④-A,①-C,②-D.
【拓展】
(4)以上方法是通过测量产生气体快慢来判断化学反应的快慢,还可以借助其它反应现象来判断反应的快慢,你认为是固体减少的快慢.
4.以下叙述中,正确的是( )
| A. | 造成空气污染的气体有一氧化碳、二氧化碳、二氧化硫等 | |
| B. | 采用加热煮沸的方法可降低水的硬度 | |
| C. | 氢氧化钠显碱性可以中和酸性土壤 | |
| D. | 汽油和洗涤剂除去油污都是乳化过程 |
 如图中A元素在周期表中的相关信息,B是该元素的原子结构示意图.
如图中A元素在周期表中的相关信息,B是该元素的原子结构示意图. 
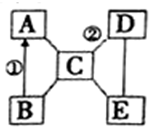 A、B、C、D、E是初中化学常见的五种不同类别的物质,其中B为红色固体,C是胃液的主要成分,E俗称苏打.图中“-”表示两端的物质间能发生化学反应,“→”表示物质间存在转化关系,部分反应物、生成物及反应条件已略去.
A、B、C、D、E是初中化学常见的五种不同类别的物质,其中B为红色固体,C是胃液的主要成分,E俗称苏打.图中“-”表示两端的物质间能发生化学反应,“→”表示物质间存在转化关系,部分反应物、生成物及反应条件已略去.