题目内容
3. 化学与生活息息相关.
化学与生活息息相关.(1)茶杯内的纱网可将茶叶与茶水分离,便于饮用.该方法利用的化学原理是过滤.
(2)自制净水器常加入活性炭,用于除去水中的异味和色素.
(3)自来水生产中常加入二氧化氯(ClO2)来消毒,其中氯元素的化合价是+4
(4)某些食品为延长食品保质期,常在食品袋内放一包“双吸剂”.如图是某食品包装袋中的“504双吸剂”,此双吸剂中铁粉的作用是吸收空气中的氧气和水蒸气,此双吸剂中使用铁粉不使用铁块的原因是铁粉增大了铁与空气的接触面积,NaCl的作用可能是加快铁锈蚀的速度.
(5)生活中使用铁锅有利于人体健康,主要是因为补充人体所需的铁元素.用完后通常用干布抹去铁锅表面的水珠,这样做的目的是防止铁生锈.
分析 (1)过滤是除去不溶性杂质的一种方法;
(2)活性炭可吸附异味和色素等;
(3)根据在化合物中正负化合价代数和为零,结合ClO2的化学式进行解答即可;
(4)根据铁生锈的条件和反应速度的影响因素考虑;
(5)根据人体需要的元素和乳化原理,铁生锈的条件考虑本题.
解答 解:(1)过滤是除去不溶性杂质的一种方法;茶杯内的纱网,可将茶叶与茶水分离,该设计利用的化学原理是过滤;故填:过滤;
(2)活性炭可吸附异味和色素等,所以可用于净水器中,用来除去水中的异味和色素;故填:活性炭.
(3)氧元素显-2价,设氯元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:x+(-2)×2=0,则x=+4价.故填:
(4)铁粉生锈是与氧气和水作用,所以铁的作用是吸收氧气和水;铁块与氧气、水的接触面积小,反应的慢;在有盐分的环境中能促进铁生锈;
故填:吸收空气中的氧气和水蒸气;铁粉增大了铁与空气的接触面积;加快铁锈蚀的速度.(只要合理即给分)
(5)铁锅可以给人体提供铁元素;用干布抹去铁锅表面的水珠,是防止铁锅生锈的.
故填:补充人体所需的铁元素;防止铁生锈.
点评 本题主要考查了过滤原理的应用,以及活性炭的作用,了解相关内容才能正确解答.

练习册系列答案
相关题目
13.用化学符号填空:
(1)2个磷原子2P;(2)4个氧离子4O2-;
(3)3个水分子3H2O;(4)正三价的铝离子$\stackrel{+3}{Al}$;
(5)四氧化三铁Fe3O4;(6)氮元素N.
(1)2个磷原子2P;(2)4个氧离子4O2-;
(3)3个水分子3H2O;(4)正三价的铝离子$\stackrel{+3}{Al}$;
(5)四氧化三铁Fe3O4;(6)氮元素N.
18.如图为元素周期表中的一格,有关金元素说法正确的是( )
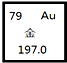

| A. | 核电荷数为276 | B. | 原子序数为118 | ||
| C. | 相对原子质量为197.0 | D. | 中子数为79 |
15.在托盘天平的两盘上各放一只质量相同的烧杯,分别注入100g 9.8%的稀硫酸,天平平衡,向左盘烧杯中投入一定质量的镁粉使其恰好与烧杯内的硫酸完全反应,天平指针发生偏转.下列各项操作中,能使天平重新达到平衡状态的是( )
| A. | 移动游码至2.4g刻度 | B. | 移动游码至2.2g刻度 | ||
| C. | 移动游码至1.2g刻度 | D. | 移动游码至1.1g刻度 |
12.除去下列各物质中含有少量杂质的方法,不合理的是( )
| 选项 | 物质 | 所含杂质 | 除去杂质的办法 |
| A | N2 | O2 | 通过足量的灼热铜网 |
| B | CO | CO2 | 通过足量的氢氧化钠溶液 |
| C | H2 | 水蒸气 | 通过盛有硫酸铜粉末的干燥管 |
| D | CO2 | CO | 点燃 |
| A. | A | B. | B | C. | C | D. | D |
6.小明同学为探究“Na2CO3溶液与稀盐酸反应是放热反应还是吸热反应”,设计并进行了3次重复实验,结果如下表:
请你帮助填写相关内容:
(1)写出该实验涉及的化学反应方程式Na2CO3+2HCl═2NaCl+H2O+CO2↑;
(2)该实验所用的仪器除烧杯、量筒、玻璃棒、保温瓶外,还必须用到的一种仪器是温度计;
(3)由上表数据可知:Na2CO3溶液与稀盐酸的反应是放热(选填:“放热“或“吸热“)反应.
| 试剂1 | 试剂2 | 混合前温度/℃ | 混合后温度/℃ | |
| 35毫升稀盐酸 | 25毫升Na2CO3溶液 | 18.O | 第1次 | 20.2 |
| 第2次 | 19.8 | |||
| 第3次 | 19.7 | |||
(1)写出该实验涉及的化学反应方程式Na2CO3+2HCl═2NaCl+H2O+CO2↑;
(2)该实验所用的仪器除烧杯、量筒、玻璃棒、保温瓶外,还必须用到的一种仪器是温度计;
(3)由上表数据可知:Na2CO3溶液与稀盐酸的反应是放热(选填:“放热“或“吸热“)反应.
