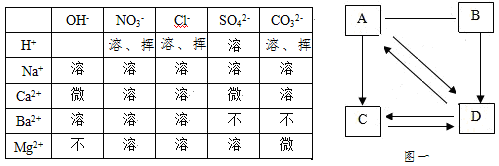
题目内容
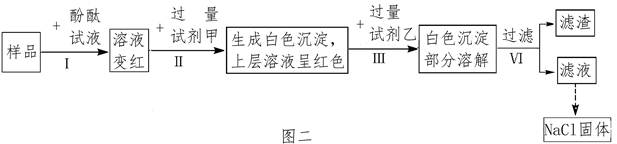
)氯化钠是日常生活中的必需品,某氯化钠样品中除含氯化钠外,还含有少量的CaCl2和MgCl2以及不溶性杂质.以下是提纯该样品的操作流程图.
请回答下列问题:
(1)操作X的名称是 .
(2)Y溶液中溶质的化学式是 .
(3)上述操作流程中共发生 个复分解反应.
(1)过滤.(2)HCl.(3)4.
解析

 阶梯计算系列答案
阶梯计算系列答案在进行酸碱中和反应的实验时,向烧杯中的氢氧化钠溶液滴加稀盐酸一会儿后,发现忘记了滴加指示剂,因而无法确定盐酸与氢氧化钠是否恰好完全反应.为了证明这两种物质是否恰好完全反应,从烧杯中取了少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液不变色.于是得出“两种物质已恰好完全中和”的结论.
(1)你认为此结论是否正确? ,理由是 ;
(2)写出该中和反应的化学方程式 ;
(3)请你另设计一个实验,探究上述烧杯中的溶液是否恰好完全中和,填写下表:
| 实验操作 | 实验现象 | 结论 |
| 从烧杯中取少量反应后的溶液于一支试管中,并向试管中滴加碳酸钠溶液 | | (填“是”、“不是”)恰好完全反应 |
(4)写出(3)中可能发生反应的化学方程式
为了区别氢氧化钠和氢氧化钙溶液,甲同学设计了如下图所示的四组实验方案。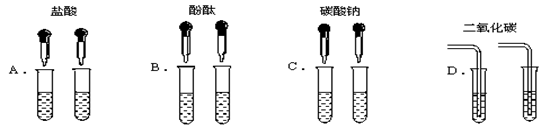
(1)其中能达到实验目的的是
(2)实验结束,甲同学将A、C组四支试管中的溶液倒入同一容器中,看到溶液变浑浊,该现象说明有 物质生成(填化学式),滴入酚酞后溶液呈红色。
(3)滴入酚酞后溶液呈红色,说明溶液呈碱性。使溶液呈碱性的物质是什么呢?甲同学进一步推测:溶液中呈碱性的物质可能是碳酸钠、氢氧化钙和 三种物质中的一种,或是三种物质两两混合组成的混合物。
(4)为了验证推测,甲同学查阅资料,获悉氯化钡溶液呈中性,并设计如下实验加以验证。请根据要求完成下列空白:
| 实验内容 | 预测现象 | 结论 |
| 取少量容器中的上层溶液于试管中,加入过量的氯化钡溶液,静置 | ①若有白色沉淀,溶液呈无色 | 物质是碳酸钠 |
| ②若无沉淀生成,溶液呈红色 | 物质是氢氧化钙 | |
| ③若有白色沉淀,溶液呈红色 | |
(6)若将一定量的Ca(OH)2溶液和100gNa2CO3溶液混合,充分反应后过滤,可得到5g白色沉淀,求该Na2CO3溶液的溶质的质量分数。
(8分)柠檬酸(C6H8O7)是一种工业原料,广泛应用于食品、医药等行业。下图是两种不同方法制备一水柠檬酸晶体(C6H8O7·H2O)的工艺流程图。回答相关问题:
【资料卡片】:
①柠檬酸水溶液显酸性,柠檬酸钙不溶于水;
②工业生产柠檬酸,原料预处理后,得到的发酵液中
含有柠檬酸及其他可溶性杂质;
③一水柠檬酸在不同温度下的溶解度如下表:
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | … |
| 溶解度/g | 96 | 118 | 146 | 183 | 216 | … |
【钙盐法制备】
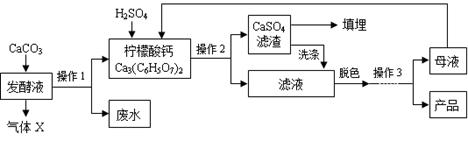
(1)气体X是 (填化学式),实验室检验该气体的化学方程式为 ;
(2)操作1、2的名称是 ;
(3)操作3的目的是得到一水柠檬酸晶体,操作顺序是b → → a;(填序号)
a.过滤 b.加热浓缩 c.冷却结晶 d.蒸发结晶
(4)工业生产中,可加入 (填序号)进行脱色处理;
A.活性炭 B.明矾 C.肥皂水
(5)洗涤CaSO4滤渣的目的是 ;
(6)母液可以循环,其中一定含有的溶质是 ;
【变温色谱分离法制备】
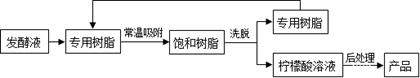
(7)对比“变温色谱分离法”,请你说出“钙盐法”的劣势 。