题目内容
为了区别氢氧化钠和氢氧化钙溶液,甲同学设计了如下图所示的四组实验方案。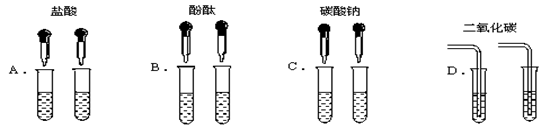
(1)其中能达到实验目的的是
(2)实验结束,甲同学将A、C组四支试管中的溶液倒入同一容器中,看到溶液变浑浊,该现象说明有 物质生成(填化学式),滴入酚酞后溶液呈红色。
(3)滴入酚酞后溶液呈红色,说明溶液呈碱性。使溶液呈碱性的物质是什么呢?甲同学进一步推测:溶液中呈碱性的物质可能是碳酸钠、氢氧化钙和 三种物质中的一种,或是三种物质两两混合组成的混合物。
(4)为了验证推测,甲同学查阅资料,获悉氯化钡溶液呈中性,并设计如下实验加以验证。请根据要求完成下列空白:
| 实验内容 | 预测现象 | 结论 |
| 取少量容器中的上层溶液于试管中,加入过量的氯化钡溶液,静置 | ①若有白色沉淀,溶液呈无色 | 物质是碳酸钠 |
| ②若无沉淀生成,溶液呈红色 | 物质是氢氧化钙 | |
| ③若有白色沉淀,溶液呈红色 | |
(6)若将一定量的Ca(OH)2溶液和100gNa2CO3溶液混合,充分反应后过滤,可得到5g白色沉淀,求该Na2CO3溶液的溶质的质量分数。
(1)C、D(1 分) (2)CaCO3(1 分) (3)NaOH(1 分)
(4)物质是碳酸钠和氢氧化钠的混合物(1 分)
(5)氢氧化钠溶液也显碱性,还可能是氢氧化钠或氢氧化钠和氢氧化钙的混合物
(6)解:设参加反应的Na2CO3的质量为x
Ca(OH)2+Na2CO3===CaCO3↓+2NaOH
106 100
x 5g x="=" 5.3 g
x="=" 5.3 g
则该Na2CO3溶液的溶质的质量分数是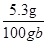 ×100%=5.3%
×100%=5.3%
答:样品中未变质的氢氧化钠的质量分数是5.3%。
解析试题分析:(1)根据氢氧化钠和氢氧化钙的性质可以知道,它们都能够和稀盐酸反应且都没有现象,都能使酚酞变红,氢氧化钠不能和碳酸钠反应,但是氢氧化钙可以和碳酸钠反应生成白色沉淀,氢氧化钠和氢氧化钙都能二氧化碳反应,但是氢氧化钠反应没有现象,和氢氧化钙反应生成白色沉淀,所以能够实现目的实验为C和D;
(2)根据题意生成的白色沉淀只能是碳酸钙,其化学式为:CaCO3;
(3)根据题意可以知道,在溶液中可能含有氢氧化钠,其化学式为:NaOH;
(4)能够和氯化钡溶液反应生成白色沉淀为碳酸钠,而氢氧化钙不能和碳酸钠共存,所以可以判断使溶液变红的是氢氧化钠,即该溶液中含有碳酸钠和氢氧化钠;
(5)氢氧化钠溶液也呈碱性,也可以使酚酞变红,所以不能仅仅根据溶液变红就判断溶液中只是氢氧化钙;
(6)已知碳酸钙质量为5g,用化学方程式计算即可。
考点:碱的化学性质;化学方程式计算

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案(5分)化学小组的同学探究二氧化碳与氢氧化钠的反应,实验方案如下:
| 实验装置 | 实验步骤及操作 | 实验现象 |
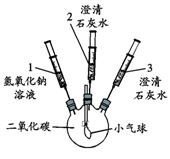 | ① 将注射器1中的溶液推入充有CO2的瓶中 | 气球鼓起 |
| ② 向外拉注射器2的活塞 | 无明显现象 | |
| ③ 将注射器3中的溶液推入瓶中 | 瓶中液体变浑浊,气球无明显变化 | |
| ④ 向外拉注射器2的活塞 | 无明显现象 |
(2)若仍要用此装置完成实验证明CO2能和NaOH反应,则步骤③注射器3中的溶液应更换为 ,对应的实验现象是 。
(3)步骤③注射器3中的溶液更换后,步骤④中对应的实验现象应为 ,发生反应的化学方程式为 。
小亮在做“盐酸中和氢氧化钠溶液”的实验时,滴加盐酸前忘了加入指示剂,导致无法判断该中和反应进行的程度。于是他对所得溶液的酸碱性进行探究。
【探究目的】探究所得溶液的酸碱性
【提出猜想】所得溶液可能呈碱性,也可能呈 性,还可能呈 性。
【实验验证】
| 实验操作 | 实验现象 | 结论 |
| 用试管取该溶液1-2mL,滴入1-2滴无色酚酞试液,振荡 | 无色酚酞试液变 | 溶液呈碱性 |
| 无色酚酞试液不变色 | 溶液呈 |
【分析与思考】
(1)若溶液呈碱性,则溶液中使其呈碱性的离子是 (填写微粒符号),为避免碱性溶液污染环境,小亮对所得溶液进行了如下处理:向溶液中逐滴加入 溶液,直到不再产生沉淀为止。然后过滤,把滤液倒入蒸发皿中加热,得到氯化钠晶体,该过程涉及的化学方程式为 。
(2)若无色酚酞试液不变色,为了进一步确定溶液的酸碱性,小亮提出了以下方案:
方案一:取样,加入碳酸钠溶液,若观察到 ,则所取溶液呈酸性;若无明显现象,则呈中性。
方案二:取样,加入金属锌,若有所泡产生,则所取溶液呈酸性,该反应的化学方程式为
;若无明显现象,则呈中性。
为了探究酸碱性对唾液淀粉酶催化作用的影响,小明利用蒸馏水、1%淀粉溶液、稀释的唾液、稀盐酸、氢氧化钠溶液、碘液等材料进行实验.请你完成相应的实验设计和问题分析.
【实验设计】
| 实验操作 | 设计要求 |
| 步骤一:取3 支洁净的试管标为A、B、c,在各试管中分别加入1%淀粉溶液2毫升;向A 试管加入l 毫升稀盐酸和l 毫升唾液;向B试管加入1 毫升氢氧化钠溶液和1 毫升唾液;向C试管加入 | 设置对照实验 |
| 步骤二: | 控制实验条件 |
| 步骤三:10分钟后,往3支试管中分别滴入1滴碘液,观察颜色变化. | 获取实验证据 |
【问题与分析】
正确操作后,小明观察到A试管呈蓝色,而B试管没有出现预期的蓝色.他想:为什么B试管不呈蓝色?他推测可能是氢氧化钠溶液变质或者B试管中液体碱性太弱.在老师的帮助下,他证实了氢氧化钠溶液没有变质,且B试管中液体碱性强度足以抑制酶的催化作用.请你对B试管没有出现蓝色作出一种合理的猜测: .
某化学兴趣小组的同学为了探究“复分解反应发生的条件”,做了两个实验:CuSO4溶液分别与NaOH溶液、BaCl2溶液反应.实验结束后将两实验中的废液倒入同一个干净的烧杯中,充分混合后过滤,得到滤液呈无色.
(1)写出废液混合后使滤液变无色时一定发生的反应的化学方程式: .
(2)取少量滤液于试管中,滴入紫色石蕊试液,石蕊溶液仍为紫色,则滤液呈 性(填“酸”、“中”、“碱”).
(3)该小组的同学对滤液中溶质的成分继续进行了如下探究实验:
【提出问题】滤液中溶质的成分是什么?
【作出猜想】猜想Ⅰ: ;猜想Ⅱ ;猜想Ⅲ .
【实验探究】
| 实验操作 | 实验现象 | 实验结论 |
| 实验①:取少量滤液于试管中,加入适量的纯碱溶液,振荡. | 无明显现象 | 猜想Ⅱ不成立 |
| 实验② | 产生白色沉淀 | 猜想Ⅲ成立 |
在实验②的溶液中滴加无色酚酞溶液,观察到酚酞溶液变成红色.
【交流拓展】要使蓝色溶液变成无色,还可以用不同于上述原理的方法,即在蓝色溶液中加入足量的 .



