题目内容
在进行酸碱中和反应的实验时,向烧杯中的氢氧化钠溶液滴加稀盐酸一会儿后,发现忘记了滴加指示剂,因而无法确定盐酸与氢氧化钠是否恰好完全反应.为了证明这两种物质是否恰好完全反应,从烧杯中取了少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液不变色.于是得出“两种物质已恰好完全中和”的结论.
(1)你认为此结论是否正确? ,理由是 ;
(2)写出该中和反应的化学方程式 ;
(3)请你另设计一个实验,探究上述烧杯中的溶液是否恰好完全中和,填写下表:
| 实验操作 | 实验现象 | 结论 |
| 从烧杯中取少量反应后的溶液于一支试管中,并向试管中滴加碳酸钠溶液 | | (填“是”、“不是”)恰好完全反应 |
(4)写出(3)中可能发生反应的化学方程式
(1)不正确 当加入的盐酸过量后,酚酞也不会变色(或当加入的盐酸过量后,盐酸也不会使酚酞变色)
(2)HCl+ NaOH="NaCl+" H2O
(3)有气泡产生(或无气泡产生) 不是(或是)(此答案对应两空方可得分)
(4)2HCl+ Na2CO3="2NaCl+" H2O+ CO2↑
解析试题分析:(1)酸使紫色石蕊试液变红色,不能使无色酚酞试液变色,所以向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液不变色,只能说明反应后的溶液中不含有NaOH,并不能确实是否含有盐酸,所以结论不正确,原因是:当加入的盐酸过量后,酚酞也不会变色(或当加入的盐酸过量后,盐酸也不会使酚酞变色)
(2)NaOH与盐酸反应的化学方程式为:HCl+ NaOH="NaCl+" H2O
(3)要探究上述烧杯中的溶液是否恰好完全中和,只需证明溶液中是否含有盐酸,所以向试管中滴加碳酸钠溶液,若有盐酸,则发生反应:2HCl+ Na2CO3="2NaCl+" H2O+ CO2↑,现象是有气泡产生,若没有盐酸,则没有现象
(4)(3)中可能发生反应的化学方程式:2HCl+ Na2CO3="2NaCl+" H2O+ CO2↑
考点:中和反应,酸的性质

 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案(9分)某化学兴趣小组在做完制取二氧化碳的实验后(用石灰石和稀盐酸制取),对反应后反应器内的剩余溶液的溶质成分产生了兴趣,他们继续进行了以下实验探究。
【分析推断】根据制取二氧化碳的反应原理,可以确定剩余溶液中一定含有氯化钙。但其中是否含有氯化氢需要通过实验来证明。
【查阅资料】氯化钙溶液呈中性。
【实验过程】将剩余的溶液倒入烧杯中,微热后冷却到室温。
| | 实验操作 | 实验现象 | 实验结论 |
| 甲同学 | 取烧杯中溶液少许于试管中,向其中滴加______ | 现象:溶液变为红色 | 溶液显酸性(含有H+);溶质中有氯化氢。 |
| 乙同学 | 取烧杯中溶液少许于试管中,向其中加入少量锌粒 | 现象:_________________________ 反应的化学方程式是: _______________________________ | |
| 丙同学 | 取烧杯中溶液少许于试管中,向其中加入少量石灰石 | 现象:_________________________ 反应的化学方程式是:____________ |
小亮在做“盐酸中和氢氧化钠溶液”的实验时,滴加盐酸前忘了加入指示剂,导致无法判断该中和反应进行的程度。于是他对所得溶液的酸碱性进行探究。
【探究目的】探究所得溶液的酸碱性
【提出猜想】所得溶液可能呈碱性,也可能呈 性,还可能呈 性。
【实验验证】
| 实验操作 | 实验现象 | 结论 |
| 用试管取该溶液1-2mL,滴入1-2滴无色酚酞试液,振荡 | 无色酚酞试液变 | 溶液呈碱性 |
| 无色酚酞试液不变色 | 溶液呈 |
【分析与思考】
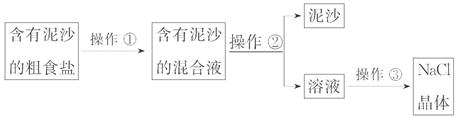
(1)若溶液呈碱性,则溶液中使其呈碱性的离子是 (填写微粒符号),为避免碱性溶液污染环境,小亮对所得溶液进行了如下处理:向溶液中逐滴加入 溶液,直到不再产生沉淀为止。然后过滤,把滤液倒入蒸发皿中加热,得到氯化钠晶体,该过程涉及的化学方程式为 。
(2)若无色酚酞试液不变色,为了进一步确定溶液的酸碱性,小亮提出了以下方案:
方案一:取样,加入碳酸钠溶液,若观察到 ,则所取溶液呈酸性;若无明显现象,则呈中性。
方案二:取样,加入金属锌,若有所泡产生,则所取溶液呈酸性,该反应的化学方程式为
;若无明显现象,则呈中性。
酸、碱、盐和氧化物的知识是初中化学重要的基础知识,以下是同学们对相关知识进行探究的过程.
(1)酸和碱的组成中都含有氢元素,如图是氢在元素周期表中的一些信息,下列对图中信息的理解或应用错误的是 .
①A表示氢原子核中含有一个质子 ②B是元素的符号 ③C是元素的名称 ④D是原子的质量
(2)盐酸,硫酸和其他的酸都有相似的化学性质,如:它们都能使酸碱指示剂变色,它们都 ;浓硫酸有 ,故可做干燥剂,但是浓硫酸不能干燥氨气,因为氨气能与硫酸反应,生成硫酸铵.该反应的化学方程式为
(3)氢氧化钠、氯化钙、硫酸铜等物质的水溶液能导电,但是它们的固体缺不能导电,这是为什么?
(4)水垢主要是由氢氧化镁和碳酸钙组成的混合物,同学们分别用稀盐酸和稀硫酸来除去水垢,发现用稀盐酸很快就能将水垢除去,但是用稀硫酸除水垢时,反应会逐渐停止.你认为稀硫酸不能将水垢完全除尽的原因是
(5)为了测定水垢中的碳酸钙的含量,同学们称取10.0g水垢放入烧杯中,分4次将稀盐酸向烧杯中加入,测得数据如下表:
| | 未加稀盐酸时 | 第一次加入10.0g稀盐酸 | 第二次加入10.0g稀盐酸 | 第三次加入10.0g稀盐酸 | 第四次加入10.0g稀盐酸 |
| 烧杯中物质总质量 | 10.0g | 18.9g | 27.8g | 36.7g | 46.7g |

为了探究酸碱性对唾液淀粉酶催化作用的影响,小明利用蒸馏水、1%淀粉溶液、稀释的唾液、稀盐酸、氢氧化钠溶液、碘液等材料进行实验.请你完成相应的实验设计和问题分析.
【实验设计】
| 实验操作 | 设计要求 |
| 步骤一:取3 支洁净的试管标为A、B、c,在各试管中分别加入1%淀粉溶液2毫升;向A 试管加入l 毫升稀盐酸和l 毫升唾液;向B试管加入1 毫升氢氧化钠溶液和1 毫升唾液;向C试管加入 | 设置对照实验 |
| 步骤二: | 控制实验条件 |
| 步骤三:10分钟后,往3支试管中分别滴入1滴碘液,观察颜色变化. | 获取实验证据 |
【问题与分析】
正确操作后,小明观察到A试管呈蓝色,而B试管没有出现预期的蓝色.他想:为什么B试管不呈蓝色?他推测可能是氢氧化钠溶液变质或者B试管中液体碱性太弱.在老师的帮助下,他证实了氢氧化钠溶液没有变质,且B试管中液体碱性强度足以抑制酶的催化作用.请你对B试管没有出现蓝色作出一种合理的猜测: .
某化学兴趣小组的同学为了探究“复分解反应发生的条件”,做了两个实验:CuSO4溶液分别与NaOH溶液、BaCl2溶液反应.实验结束后将两实验中的废液倒入同一个干净的烧杯中,充分混合后过滤,得到滤液呈无色.
(1)写出废液混合后使滤液变无色时一定发生的反应的化学方程式: .
(2)取少量滤液于试管中,滴入紫色石蕊试液,石蕊溶液仍为紫色,则滤液呈 性(填“酸”、“中”、“碱”).
(3)该小组的同学对滤液中溶质的成分继续进行了如下探究实验:
【提出问题】滤液中溶质的成分是什么?
【作出猜想】猜想Ⅰ: ;猜想Ⅱ ;猜想Ⅲ .
【实验探究】
| 实验操作 | 实验现象 | 实验结论 |
| 实验①:取少量滤液于试管中,加入适量的纯碱溶液,振荡. | 无明显现象 | 猜想Ⅱ不成立 |
| 实验② | 产生白色沉淀 | 猜想Ⅲ成立 |
在实验②的溶液中滴加无色酚酞溶液,观察到酚酞溶液变成红色.
【交流拓展】要使蓝色溶液变成无色,还可以用不同于上述原理的方法,即在蓝色溶液中加入足量的 .
 ),则可能的原因是(填字母) 。
),则可能的原因是(填字母) 。
