题目内容
17.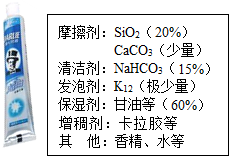 牙膏是生活必需品,某兴趣小组同学对某品牌市售牙膏展开如下探究,请回答问题:
牙膏是生活必需品,某兴趣小组同学对某品牌市售牙膏展开如下探究,请回答问题:【资料卡片】:
a、SiO2不溶于水、且不与酸反应,高温不分解;
b、NaHCO3受热易分解,生成Na2CO3、H2O、CO2;
c、牙膏中保湿剂、增稠剂、香精等均为有机物.
(1)取一小段牙膏,加入蒸馏水,充分搅拌后静置,测得其上层清液的pH为8.3,则此牙膏显弱碱性性,实验室能否用pH试纸测得该数值,请你作出判断并说明理由.不能,因为pH试纸只能测定出整数值;
(2)小岳同学发现,此品牌牙膏在冬季会出现颗粒变大的现象.资料显示是牙膏中的K12(一种钠盐)析出,则K12的溶解度和温度的关系是K12的溶解度随温度降低而降低(或随温度升高而增大);
(3)为测定此牙膏中SiO2的质量分数,兴趣小组同学设计了如下方案,并进行了3次实验:
【实验步骤】:
①准确称取2.0g牙膏膏体,烘干水分,高温加热,至质量不再减轻为止,在干燥器中冷却至室温;
②转移剩余物至烧杯中,加入稀HCl,至气体不再产生为止;
③过滤、洗涤、称量得到剩余固体质量(如表);
| 实验编号 | 1 | 2 | 3 |
| 实验前(g) | 2.00 | 2.00 | 2.00 |
| 试验后(g) | 0.43 | 0.44 | 0.45 |
【数据处理】:
(4)此测定做3次实验的目的是提高实验的精确度(或可信度);
(5)综合上述实验方案及实验数据,计算此牙膏中SiO2的质量分数.22%;
【实验分析】:
(6)按上述实验步骤操作,发现测定结果偏大,导致偏大的原因可能是步骤③中,没有将剩余固体进行干燥,有洗涤液附着在固体表面;
(7)高温加热的目的除为了除去CaCO3及NaHCO3以外,还为除去保湿剂、增稠剂、香精等有机物;
(8)步骤②中,加稀HCl发生的反应有CaO+2HCl═CaCl2+H2O、Na2CO3+2HCl═2NaCl+H2O+CO2↑;
(9)步骤③中,洗涤的目的是除去固体表面附着的CaCl2和NaCl溶液;若不洗涤,则测定结果将偏大.(填“偏大”、“偏小”或“不变”)
(10)为保证洗涤效果,最好用A洗涤.
A.蒸馏水 B.自来水 C.饱和NaCl溶液 D.饱和CaCl2溶液.
分析 (1)根据测得其上层清液的pH为8.3大于7进行解答;
(2)根据牙膏中的K12在冬天析出进行解答;
(3)根据碳酸钠和盐酸反应生成二氧化碳进行解答;
(4)根据此测定做3次实验的目的是提高实验的精确度进行解答;
(5)根据剩余固体的质量就是二氧化硅的质量进行解答;
(6)根据步骤③中,没有将剩余固体进行干燥,有洗涤液附着在固体表面进行解答;
(7)根据保湿剂、增稠剂、香精等有机物加热会挥发进行解答;
(8)根据①中的固体有二氧化硅、氧化钙、碳酸钠进行进行解答;
(9)根据洗涤的目的是除去固体表面附着的CaCl2和NaCl溶液进行解答;
(10)根据蒸馏水中不含有其他可溶性物质进行解答.
解答 解:(1)测得其上层清液的pH为8.3大于7,所以则此牙膏显弱碱性;pH试纸只能测定出整数值,而测得清液的pH为8.3,所以实验室不能用pH试纸测得该数值;
(2)牙膏中的K12在冬天析出,说明K12的溶解度随温度降低而降低(或随温度升高而增大);
(3)碳酸钠和盐酸反应生成二氧化碳,所以转移剩余物至烧杯中,加入稀HCl,至气体不再产生为止;
(4)此测定做3次实验的目的是提高实验的精确度(或可信度);
(5)剩余固体的质量就是二氧化硅的质量,3次实验所得SiO2的平均值为0.44g.
此牙膏中SiO2的质量分数$\frac{0.44g}{2.0g}$×100%=22%;
(6)步骤③中,没有将剩余固体进行干燥,有洗涤液附着在固体表面,会使得测定结果偏大;
(7)保湿剂、增稠剂、香精等有机物加热会挥发,所以高温加热的目的除为了除去CaCO3及NaHCO3以外,还为除去保湿剂、增稠剂、香精等有机物;
(8)①中的固体有二氧化硅、氧化钙、碳酸钠,所以加稀HCl发生的反应有氧化钙和盐酸反应生成氯化钙和水,以及碳酸钠和盐酸反应生成氯化钠、水、二氧化碳,化学方程式分别为CaO+2HCl═CaCl2+H2O、Na2CO3+2HCl═2NaCl+H2O+CO2↑;
(9)洗涤的目的是除去固体表面附着的CaCl2和NaCl溶液,若不洗涤,则测定结果将偏大;
(10)蒸馏水中不含有其他可溶性物质,所以为保证洗涤效果,最好用蒸馏水洗涤.
故答案为:(1)弱碱性;不能,因为pH试纸只能测定出整数值;
(2)K12的溶解度随温度降低而降低(或随温度升高而增大);
(3)气体不再产生为止;
(4)提高实验的精确度(或可信度);
(5)22%;
(6)步骤③中,没有将剩余固体进行干燥,有洗涤液附着在固体表面;
(7)保湿剂、增稠剂、香精等有机物;
(8)CaO+2HCl═CaCl2+H2O;Na2CO3+2HCl═2NaCl+H2O+CO2↑;
(9)除去固体表面附着的CaCl2和NaCl溶液;偏大;
(10)A.
点评 本题就牙膏问题对所学的化学知识:物质的组成、碳酸钙和稀盐酸的反应、二氧化碳和氢氧化钙的反应考查,要熟练掌握这些知识,书写化学方程式一定要准确无误.

 全能测控一本好卷系列答案
全能测控一本好卷系列答案| 序号 | 物 质 | 选用试剂 |
| A | CaCl2溶液(盐酸) | 过量的Na2CO3溶液 |
| B | NaOH溶液(Na2CO3溶液) | 适量的Ca(OH)2溶液 |
| C | CuO(Cu) | 足量的稀H2SO4 |
| D | KCl溶液(K2SO4溶液) | 适量的Ba(NO3)2溶液 |
| A. | A | B. | B | C. | C | D. | D |
| A. |  加热液体 | B. |  滴加液体 | C. |  加热蒸发 | D. |  测定溶液pH |

请分析实验过程,回答下列问题:
(1)白色粉末中一定不含CuSO4、Na2SO4;可能含有NaOH.
(2)生成白色沉淀的化学方程式为Na2CO3+BaCl2=BaCO3↓+2NaCl.
(3)为最终确定白色粉末的组成,还需要对无色滤液中呈碱性的物质进行探究.
【提出问题】无色滤液中呈碱性的物质是什么?
【作出猜想】
猜想Ⅰ:Na2CO3
猜想Ⅱ:NaOH
猜想Ⅲ:Na2CO3和NaOH
【进行实验】
| 实验步骤 | 实验现象 | 实验结论 |
| ①取无色滤液少许于试管中,滴加过量的BaCl2溶液 | 产生白色沉淀 | 猜想Ⅱ不成立 |
| ②在①反应后的试管中滴加无色酚酞溶液 | 溶液变为红色 | 猜想Ⅲ成立 |
| A. | 用肥皂水鉴别硬水和软水 | |
| B. | 用灼烧的方法鉴别羊毛和合成纤维 | |
| C. | 用二氧化锰区别水和过氧化氢溶液 | |
| D. | 根据外观和是否溶于水鉴别食盐和白糖 |
①SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si(粗)+2CO↑
②Si(粗)+3HCl$\frac{\underline{\;\;△\;\;}}{\;}$SiHCl3+H2
③SiHCl3+H2$\frac{\underline{\;高温\;}}{\;}$Si(纯)+3HCl.
下列说法错误的是( )
| A. | ①②③属于同一反应类型 | B. | 上述反应进行中不能有O2存在 | ||
| C. | ②③的目的是将粗硅提纯 | D. | 反应①中,CO是还原剂 |
(1)CaC2中C的化合价为-1.
(2)对白色固体的成分做出猜想,猜想一:CaO,猜想二:CaCO3,你认为猜想甲不成立理由是氧化钙能与水反应生成氢氧化钙.
(3)如果你的猜想不同与它们,那么你猜想的白色固体是什么?请你设计一个实验方案来证明你的猜想是正确的,并填写在下列表格中.
| 提出问题,白色固体是什么 | 实验操作 | 实验现象 | 实验结论 |
| 白色固体是氢氧化钙 | 将固体加入足量水中溶解,过滤,在滤液中加入Na2CO3溶液(不能用酸碱指示剂) | 产生白色沉淀 | 猜想成立 |

