题目内容
14.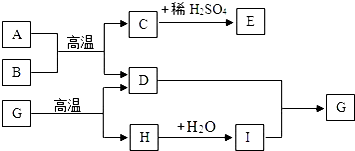 A~J是初中化学中常见的物质,其中A为一种化合物气体,B为红棕色固体,E为浅绿色溶液,H是一种食品干燥剂,它们之间的关系如下图(部分反应物或生成物已略去).
A~J是初中化学中常见的物质,其中A为一种化合物气体,B为红棕色固体,E为浅绿色溶液,H是一种食品干燥剂,它们之间的关系如下图(部分反应物或生成物已略去).(1)G的化学式为CaCO3;
(2)实验室制氢气,一般不选择C和稀硫酸反应,原因是反应速率太慢;
(3)C→E的反应前后溶液质量将增大(填“增大”或“减小”或“不变”);该反应类型属于置换反应
(4)A+B的化学反应方程式是3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;H→I的化学反应方程式是CaO+H2O═Ca(OH)2;
(5)取12g G高温煅烧,充分反应后剩余固体的质量为7.6g,请判断G是属于混合物(填“纯净物”或“混合物”);若是混合物,则G中主要成分的质量分数为83.3%(保留一位小数,若是纯净物,此空不用填).
分析 A为一种化合物气体,B为红棕色固体,A和B反应生成的C和稀硫酸反应生成的E为浅绿色溶液,可以判断E为硫酸亚铁溶液,进而可以判断A为一氧化碳,B为氧化铁,C为铁,D为二氧化碳,G在高温的条件反应生成了二氧化碳和H,且H为食品干燥剂,所以可以判断H为氧化钙,I为氢氧化钙,氢氧化钙和二氧化碳反应生成了碳酸钙,满足我们的推断,故可以据此答题.
解答 解:A为一种化合物气体,B为红棕色固体,A和B反应生成的C和稀硫酸反应生成的E为浅绿色溶液,可以判断E为硫酸亚铁溶液,进而可以判断A为一氧化碳,B为氧化铁,C为铁,D为二氧化碳,G在高温的条件反应生成了二氧化碳和H,且H为食品干燥剂,所以可以判断H为氧化钙,I为氢氧化钙,氢氧化钙和二氧化碳反应生成了碳酸钙,所以据此可以完成下列解答:
(1)G为碳酸钙,其化学式为CaCO3;
(2)C为铁,其与稀硫酸反应时速率较慢,所以一般不用作实验室中制取氢气;
(3)C→E的反应为铁和硫酸的反应,根据反应中各物质的质量关系可以知道,每56份质量的铁和足量的硫酸反应能够生成2份质量的氢气,所以可以判断该反应前后溶液质量增大;铁和硫酸的反应为置换反应;
(4))A+B的反应为一氧化碳和氧化铁的反应,该反应的化学方程式为:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;H→I的反应为氧化钙和水的反应,其反应的化学反应方程式是;CaO+H2O═Ca(OH)2;
(5)由质量守恒定律,生成二氧化碳的质量为12g-7.6g=4.4g.
设参加反应的碳酸钙的质量为x
CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑
100 56 44
x y 4.4g
$\frac{100}{x}$=$\frac{56}{y}$=$\frac{44}{4.4g}$
解得:x=10g,y=5.6g
而反应后剩余的物质为7.6g,所以可以判断反应后的物质为混合物;进而可以判断12gG中含有2g杂质,
其中碳酸钙的质量分数为:$\frac{12g-10g}{12g}$×100%=83.3%
故答案为:(1)CaCO3;
(2)反应速率太慢;
(3)增大;置换反应;
(4)3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;CaO+H2O═Ca(OH)2;
(5)混合物,83.3%.
点评 在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质在题中的转换关系推导剩余的物质,最后进行验证即可.

 阅读快车系列答案
阅读快车系列答案| A. | 糖类主要为人体提供能量 | B. | 青少年常饮牛奶有利于骨骼生长 | ||
| C. | 多吃水果蔬菜可补充维生素 | D. | 六大基本营养素不含无机盐 |
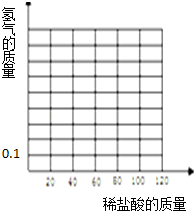 某同学为了测试一段表面被氧化的镁条的纯度.取11.6g该镁条于烧杯中,向烧杯中分五次加入等质量的同种稀盐酸,实验过程中得到的数据如下:
某同学为了测试一段表面被氧化的镁条的纯度.取11.6g该镁条于烧杯中,向烧杯中分五次加入等质量的同种稀盐酸,实验过程中得到的数据如下:| 第1次 | 第2次 | 第3次 | 第4次 | 第5次 | |
| 加入稀盐酸的质量 | 20g | 20g | 20g | 20g | 20g |
| 产生氢气的质量 | 0.1g | 0.2g | 0.2g | mg | 0.1g |
(1)m 的值为0.2;
(2)根据上述数据计算出镁条的纯度;(要求写出计算过程,结果精确到0.1%,下同)
(3)反应结束后所得溶液中氯化镁的质量分数为38.6%;
(4)在坐标图中画出所加盐酸与产生氢气的质量关系图.
| A. | 软水和硬水:滴加肥皂水 | B. | 氧气和二氧化碳:滴加澄清石灰水 | ||
| C. | 铁片和银片:观察颜色 | D. | 二氧化硫和氢气:闻气味 |
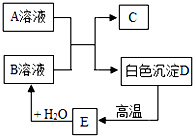 A、B、C、D、E都是初中化学中的常见物质,相互之间存在以下转化关系.其中A是一种盐,广泛用于玻璃、造纸、纺织和洗涤的生产等;D是大理石的主要成分,大量用于建筑业.
A、B、C、D、E都是初中化学中的常见物质,相互之间存在以下转化关系.其中A是一种盐,广泛用于玻璃、造纸、纺织和洗涤的生产等;D是大理石的主要成分,大量用于建筑业. 水是一种重要的物质,在实验室和日常生活中有着十分重要的作用,但有时也会干扰我们的生活.请根据下列提示回答问题:
水是一种重要的物质,在实验室和日常生活中有着十分重要的作用,但有时也会干扰我们的生活.请根据下列提示回答问题: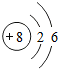 ,Si的元素名称是硅;
,Si的元素名称是硅;