题目内容
14.根据如图提供的信息,回答相关问题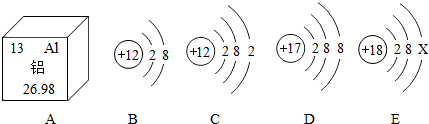
(1)图A中铝原子的核电荷数为13,2个铝离子用化学符号表示为2Al3+A中铝元素与地壳中含量最多的非金属元素形成化合物的化学式为Al2O3.
(2)E中X为8,C在化学反应中是失(填“得”或“失”)电子达到稳定结构.
(3)用元素符号写出B和D两种粒子构成化合物的化学式MgCl2.
分析 (1)左上角数字是原子序数,等于核电荷数;铝离子带3个单位正电荷,标在元素符号的右上角;根据化学式的书写,写出化学式;
(2)根据核内质子数等于核外电子数,求出x的数值;最外层电子数少于4个易失去电子,多于4个,易得电子;
(3)根据镁元素显+2价,氯元素显-1价,写出化学式即可.
解答 解:(1)左上角数字是原子序数,等于核电荷数,所以图A中铝原子的核电荷数为13;铝离子带3个单位正电荷,标在元素符号的右上角,所以2个铝离子用化学符号表示为2Al3+;铝元素化合价是+3价,地壳中含量最多的非金属元素是氧元素,化合价是-2价,所以化学式是Al2O3;
(2)核内质子数等于核外电子数,所以x的数值是8;最外层电子数少于4个易失去电子,多于4个,易得电子,C的最外层电子数是2,易失去电子;
(3)镁元素显+2价,氯元素显-1价,所以化学式是MgCl2.
故答案为:(1)13;2Al3+;Al2O3;(2)8;失(3)MgCl2.
点评 解答本题关键是知道离子的写法,化学式的书写方法:正价在前,负价在后,先约简再交叉.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.某课外小组在研究金属与酸的化学反应时,设计了以下三个实验.

某课外小组在研究金属与酸的化学反应时,设计了以下三个实验:
【实验一】锰为不锈钢主要的添加元素.锰的氧化物是不锈钢的保护膜,可以提高不锈钢的耐腐蚀性.
(1)相同温度下,取大小相同、表面光亮的锰、镁、铜三种金属片,分别投人足量的、质量分数相同的稀盐酸中(反应中锰的化合价为+2价),现象如下:
上述三种金属的活动性由弱到强的顺序是铜锰镁;写出锰与稀盐酸反应的化学方程式:Mn+2HCl═MnCl2+H2↑.
(2)金属与酸的反应存在某种规律,请你分析下表中的数据,找到对应关系.
【实验二】应用:完成下列实验方案,(要求采用与实验一中不同的方法)
【实验三】根据不同种金属与同种酸能否反应以及反应的剧烈程度,可判断金属的活动性.也可根据同种金属与不同种酸反应的快慢,来判断不同种酸的酸性强弱.为比较盐酸和醋酸的酸性强弱,设计了如下实验方案.装置如图1所示(夹持和固定装置已略去).在两试管中分别加人过量镁条,同时将相同浓度的稀盐酸和稀醋酸注人相应试管中,观察产生氢气的速率和体积.试回答下列问题:
(1)盐酸与镁反应的化学方程式为Mg+2HCl=MgCl2+H2↑,基本类型为置换反应.
(2)实验中收集到氢气的体积与时间的关系如图2所示.分析图中曲线变化规律,可得出盐酸酸性比醋酸强(填“强”或“弱”).
(3)实验中稀盐酸与镁条反应时,量筒中收集到氢气的体积比理论值高,可能的原因是①④.
①反应放热
②试管中有氢气残留
③实验装置气密性不好
④酸液进入试管,占据了一定的体积.

某课外小组在研究金属与酸的化学反应时,设计了以下三个实验:
【实验一】锰为不锈钢主要的添加元素.锰的氧化物是不锈钢的保护膜,可以提高不锈钢的耐腐蚀性.
(1)相同温度下,取大小相同、表面光亮的锰、镁、铜三种金属片,分别投人足量的、质量分数相同的稀盐酸中(反应中锰的化合价为+2价),现象如下:
| 金属种类 | 锰(Mn) | 镁 | 铜 |
| 与盐酸反应 | 略慢 | 快 | 无明显现象 |
(2)金属与酸的反应存在某种规律,请你分析下表中的数据,找到对应关系.
| 等质量的金属(a克)与足量盐酸反应 | 镁 | 铁 | 锰 |
| 金属的相对原子质量 | 24 | 56 | 55 |
| 产生氢气的质量(g) | $\frac{a}{12}$ | $\frac{a}{28}$ | $\frac{a}{27.5}$ |
| 找到的规律 | 化合价相同的情况下,相对原子质量越大产生的氢气质量越小 (只描述规律,不写前提) | ||
| 实验目的 | 实验操作 | 实验现象和结论 |
| 探究Mn和Cu的金属活动性强弱 |
(1)盐酸与镁反应的化学方程式为Mg+2HCl=MgCl2+H2↑,基本类型为置换反应.
(2)实验中收集到氢气的体积与时间的关系如图2所示.分析图中曲线变化规律,可得出盐酸酸性比醋酸强(填“强”或“弱”).
(3)实验中稀盐酸与镁条反应时,量筒中收集到氢气的体积比理论值高,可能的原因是①④.
①反应放热
②试管中有氢气残留
③实验装置气密性不好
④酸液进入试管,占据了一定的体积.
2. 如图是电解水的装置.下列关于电解水实验的说法正确的是( )
如图是电解水的装置.下列关于电解水实验的说法正确的是( )
 如图是电解水的装置.下列关于电解水实验的说法正确的是( )
如图是电解水的装置.下列关于电解水实验的说法正确的是( )| A. | 通电一段时间后,a、b两管气体的质量比约是1:2 | |
| B. | 1是电源的负极 | |
| C. | 用燃着的木条检验产生的气体:a气体能燃烧,b气体使木条燃烧的更旺 | |
| D. | 实验得出水由氢元素和氧元素组成 |
9.下列关于O2的叙述不正确的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |
6.物质的量是由质量数和单位来表述的,利用化学方程式进行计算设未知量时,我们应设为x,而不应设为x g.因为前者x代表质量,后者x表示质量数必须加单位才能表示质量.下列理由最充分的是( )
| A. | 化学方程式计算的理论基础是质量守恒定律 | |
| B. | 化学方程式中各物质的质量对应成正比 | |
| C. | 利用化学方程式计算的依据是化学方程式 | |
| D. | 化学方程式的计算是利用质量比,不是质量数之比 |
4.某兴趣小组同学阅读课外资料得知:很多因素都能影响过氧化氢分解速度.于是,同学们探究影响过氧化氢分解速度的某种因素.
【实验过程】实验数据记录如下:
【实验分析】
(1)过氧化氢分解的符号表达式为H2O2$\stackrel{MnO_{2}}{→}$H2O+O2.
(2)表格中的“测量数据”的指的是:相同时间内收集到的氧气的体积.
(3)本实验中,测量O2体积的装置是(填编号)C.
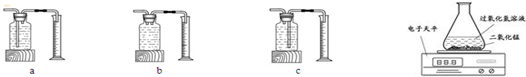
【实验结论】在相同条件下浓度越大,产生氧气的速度越快.
【实验反思】有同学提出使用电子天平用右上方的装置图进行实验,通过比较相同时间产生氧气的质量等也能达到实验目的.
【实验过程】实验数据记录如下:
| 过氧化氢溶液的质量 | 过氧化氢溶液的浓度 | MnO2的质量 | 测量数据 | |
| Ⅰ | 50.0g | 1% | 0.1g | 9mL |
| Ⅱ | 50.0g | 2% | 0.1g | 16mL |
| Ⅲ | 50.0g | 4% | 0.1g | 31mL |
(1)过氧化氢分解的符号表达式为H2O2$\stackrel{MnO_{2}}{→}$H2O+O2.
(2)表格中的“测量数据”的指的是:相同时间内收集到的氧气的体积.
(3)本实验中,测量O2体积的装置是(填编号)C.

【实验结论】在相同条件下浓度越大,产生氧气的速度越快.
【实验反思】有同学提出使用电子天平用右上方的装置图进行实验,通过比较相同时间产生氧气的质量等也能达到实验目的.