题目内容
4.某兴趣小组同学阅读课外资料得知:很多因素都能影响过氧化氢分解速度.于是,同学们探究影响过氧化氢分解速度的某种因素.【实验过程】实验数据记录如下:
| 过氧化氢溶液的质量 | 过氧化氢溶液的浓度 | MnO2的质量 | 测量数据 | |
| Ⅰ | 50.0g | 1% | 0.1g | 9mL |
| Ⅱ | 50.0g | 2% | 0.1g | 16mL |
| Ⅲ | 50.0g | 4% | 0.1g | 31mL |
(1)过氧化氢分解的符号表达式为H2O2$\stackrel{MnO_{2}}{→}$H2O+O2.
(2)表格中的“测量数据”的指的是:相同时间内收集到的氧气的体积.
(3)本实验中,测量O2体积的装置是(填编号)C.
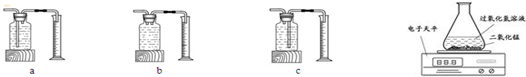
【实验结论】在相同条件下浓度越大,产生氧气的速度越快.
【实验反思】有同学提出使用电子天平用右上方的装置图进行实验,通过比较相同时间产生氧气的质量等也能达到实验目的.
分析 【实验分析】
(1)根据过氧化氢溶液和二氧化锰混合生成水和氧气进行解答;
(2)根据实验数据可知表格中的“测量数据”的指的是:相同时间内收集氧气的体积进行解答;
(3)根据氧气的密度比水的密度小,所以气体应该从短管进,长管出进行解答;
【实验结论】根据图中数据可知双氧水浓度越大,产生氧气速度越快进行解答;
【实验反思】根据通过收集等体积氧气所需要的时间测量也能得出相同的结论进行解答.
解答 解:【实验分析】
(1)过氧化氢溶液和二氧化锰混合生成水和氧气,故化学方程式为2H2O2 $\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
(2)实验数据可知表格中的“测量数据”的指的是:相同时间内收集氧气的体积;故答案为:收集到的氧气的体积;
(3)氧气的密度比水的密度小,所以气体应该从短管进,长管出,所以选择装置C;故答案为:C;
【实验结论】根据图中数据可知双氧水浓度越大,产生氧气速度越快;故答案为:浓度越大,产生氧气的速度越快;
【实验反思】相同质量的过氧化氢溶液,加入不同质量的MnO2,记录相同时间内产生O2体积也能达到实验目的;故答案为:相同时间产生氧气的质量等.
点评 本题难度适中,考查了影响化学反应速率的因素,掌握控制变量法的应用、量气装置等是正确解答本题的关键.

练习册系列答案
相关题目
12.近年来,北京、长沙等许多城市出现雾霾天气,PM2.5是造成雾霾天气的“元凶”之一.下列做法不会增加空气中PM2.5的是( )
| A. | 冬天居民家家都燃煤供暖 | B. | 燃放烟花爆竹 | ||
| C. | 焚烧农作物秸秆和垃圾 | D. | 使用太阳能热水器 |
19.下列化学用语与含义相符的是( )
| A. | Na1+:钠离子 | B. | 2H:2个氢元素 | C. | O2:2个氧原子 | D. | Fe2O3:氧化铁 |
 海水淡化可缓解淡水资源匮乏问题.图为从海水中获取淡水的装置示意图.
海水淡化可缓解淡水资源匮乏问题.图为从海水中获取淡水的装置示意图.
 根据所学知识回答:
根据所学知识回答:

