题目内容
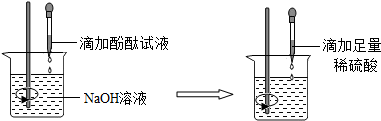
13.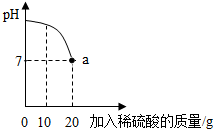 实验室有一瓶标签被腐蚀的稀硫酸溶液,小丽为了测定该稀硫酸溶液中溶质的质量分数,在烧杯中配制了16g10%的氢氧化钠溶液,然后往烧杯中滴加该稀硫酸溶液.反应过程中该溶液的pH与滴入稀硫酸溶液的质量关系如图所示.请回答下列的问题:
实验室有一瓶标签被腐蚀的稀硫酸溶液,小丽为了测定该稀硫酸溶液中溶质的质量分数,在烧杯中配制了16g10%的氢氧化钠溶液,然后往烧杯中滴加该稀硫酸溶液.反应过程中该溶液的pH与滴入稀硫酸溶液的质量关系如图所示.请回答下列的问题:(1)图中a点所表示的意义:酸碱恰好完全反应.
(2)根据化学方程式及图中信息,计算该稀硫酸溶液的质量分数.(写出计算过程)
(3)当滴入10g稀硫酸溶液时,烧杯内溶液中钠元素的质量为0.92g.
分析 (1)图中a点的pH值进行分析;
(2)根据氢氧化钠的质量结合化学方程式计算反应的硫酸的质量,计算该稀硫酸的溶质质量分数;
(3)根据质量守恒定律,无论滴加盐酸的质量为多少,溶液中钠元素的质量等于氢氧化钠溶液中钠元素的质量.
解答 解:(1)图中a点的pH=7,表示酸碱恰好完全反应;故填:酸碱恰好完全反应;
(2)设20g稀硫酸中硫酸的质量为x,
2NaOH+H2SO4=Na2SO4+2H2O
80 98
16g×10% x
$\frac{80}{16g×10%}=\frac{98}{x}$,
x=1.96g,
该盐酸的溶质质量分数为:$\frac{1.96g}{20g}$×100%=9.8%,
答:该盐酸的溶质质量分数为9.8%.
(3)当滴入10g硫酸时,烧杯内溶液中钠元素的质量为:16g×10%×$\frac{23}{40}$×100%=0.92g,
故填:0.92.
点评 本题主要考查学生运用化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.以下是某研究小组探究影响化学反应快慢的一些因素的相关数据(常温通常指20℃)
(1)通过实验①和②对比可知,化学反应快慢与反应物的浓度有关;
(2)通过对比实验③和④可知,化学反应快慢与温度的关系是温度越高,化学反应的速率越快.
| 实验序号 | 过氧化氢溶液浓度/% | 过氧化氢溶液质量/g | 温度/℃ | 二氧化锰用量/g | 氧气体积/ml | 反应所需时间/s |
| ① | 5 | 12 | 20 | 0.2 | 125 | 11 |
| ② | 30 | 12 | 20 | 0.2 | 125 | 2 |
| ③ | 30 | 12 | 40 | / | 125 | 148 |
| ④ | 30 | 12 | 90 | / | 125 | 82 |
(2)通过对比实验③和④可知,化学反应快慢与温度的关系是温度越高,化学反应的速率越快.
8.下列转化不能通过一步反应实现的是( )
| A. | Fe2O3→FeSO4 | B. | Fe→FeS | C. | Fe2(SO4)3→Fe(OH)3 | D. | Fe→FeCl2 |
18. 如图表示M、N两种固体物质的溶解度曲线.下列说法正确的是( )
如图表示M、N两种固体物质的溶解度曲线.下列说法正确的是( )
 如图表示M、N两种固体物质的溶解度曲线.下列说法正确的是( )
如图表示M、N两种固体物质的溶解度曲线.下列说法正确的是( )| A. | 20℃时,M的溶解度大于N的溶解度 | B. | M、N都不是易溶物质 | ||
| C. | P点表示t℃时M、N的溶解度相等 | D. | 阴影处M、N均为饱和溶液 |
5.某同学在实验室进行有关浓硫酸的实验,观察到瓶上的标签如表所示.他从瓶中倒出300毫升用于配制稀硫酸.求:
(1)这300毫升浓硫酸的质量是多少克?其中含溶质硫酸多少克?
(2)欲配制1000毫升(密度为1.14克/厘米3)质量分数为19.6%的稀硫酸,需要这种浓硫酸和水各多少毫升?
| 浓硫酸 500毫升 | |
| 溶质的质量分数 | 98% |
| 密度 | 1.84克/厘米3 |
| 强腐蚀性,阴冷,密封储藏 | |
(2)欲配制1000毫升(密度为1.14克/厘米3)质量分数为19.6%的稀硫酸,需要这种浓硫酸和水各多少毫升?
3.下图中,不属于模型的是( )
| A. |  | B. |  | C. |  | D. |  |