题目内容
5.某同学在实验室进行有关浓硫酸的实验,观察到瓶上的标签如表所示.他从瓶中倒出300毫升用于配制稀硫酸.求:| 浓硫酸 500毫升 | |
| 溶质的质量分数 | 98% |
| 密度 | 1.84克/厘米3 |
| 强腐蚀性,阴冷,密封储藏 | |
(2)欲配制1000毫升(密度为1.14克/厘米3)质量分数为19.6%的稀硫酸,需要这种浓硫酸和水各多少毫升?
分析 根据配制溶液的步骤,以及溶液的质量=溶液的密度×溶液的体积,溶质的质量=溶液的质量×溶质的质量分数,溶质的质量分数=$\frac{溶质质量}{溶液质量}$×100%进行分析解答.
解答 解:(1)300ml浓硫酸的质量为:m=ρv=1.84g/cm3×300cm3=552g;
300ml浓硫酸的溶质质量为:552g×98%=540.96g;
(2)设需浓硫酸质量为m
m×98%=1000cm3×1.14g/cm3×19.6%
m=228g
则V=$\frac{228g}{1.84g/c{m}^{3}}$=123.9cm3=123.9ml
需水质量1140g-228g=912g
V水=$\frac{912g}{1g/c{m}^{3}}$=912cm3=912ml.
故答案为:(1)552g;540.96g;
(2)123.9ml,912ml.
点评 本题主要考查了学生对于溶质的质量、溶液的质量及溶质的质量分数之间的关系,以及依据题意计算的能力,要根据题目信息细心分析解答.

练习册系列答案
 学习实践园地系列答案
学习实践园地系列答案
相关题目
16.下列厨房用具,在空气中最容易锈蚀的是( )
| A. | 铝壶 | B. | 不锈钢汤勺 | C. | 铁锅 | D. | 纯铜把手 |
14.金属材料在生产、生活中科学研究中应用广泛.
(1)如表示A、B、C三种金属的部分物理性质
①三种金属中最不适宜作导线的是C(填字母),高压电线不用金属A而选用B,主要原因是高压线一般需要较大的横截面,且为高空架设,故宜选用密度小、导电性能较好的金属.
②C的合金通常可以做菜刀、锤子等,是因为其合金的硬度较纯C大(填“大”或“小”).
(2)某化学小组以某工业废水水样为研究对象,在实验室中完成以下实验.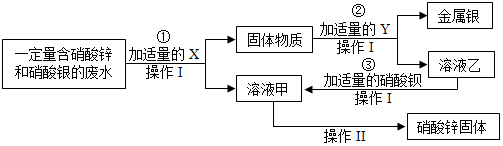
①该小组的实验目的是从工业废水中回收金属银和硝酸锌固体.
②物质x是锌;溶液乙中溶质是硫酸锌;反应③的基本反应类型是复分解反应.
③操作Ⅰ和操作Ⅱ中都要用到一种或几种玻璃仪器,该仪器在操作Ⅱ中的作用是搅拌、防止因局部温度过高造成液滴飞溅.
(1)如表示A、B、C三种金属的部分物理性质
| 金属 | 导电性(100为标准) | 密度(g/cm3) | 熔点(℃) |
| A | 99 | 8.92 | 1083 |
| B | 61 | 2.70 | 660 |
| C | 17 | 7.86 | 1535 |
②C的合金通常可以做菜刀、锤子等,是因为其合金的硬度较纯C大(填“大”或“小”).
(2)某化学小组以某工业废水水样为研究对象,在实验室中完成以下实验.

①该小组的实验目的是从工业废水中回收金属银和硝酸锌固体.
②物质x是锌;溶液乙中溶质是硫酸锌;反应③的基本反应类型是复分解反应.
③操作Ⅰ和操作Ⅱ中都要用到一种或几种玻璃仪器,该仪器在操作Ⅱ中的作用是搅拌、防止因局部温度过高造成液滴飞溅.
15. 如图,表示在一定条件下发生的某化学反应,则下列说法正确的是( )
如图,表示在一定条件下发生的某化学反应,则下列说法正确的是( )
 如图,表示在一定条件下发生的某化学反应,则下列说法正确的是( )
如图,表示在一定条件下发生的某化学反应,则下列说法正确的是( )| A. | 两种反应物均为化合物 | B. | 该反应不符合质量守恒定律 | ||
| C. | 该反应前后元素的种类发生了改变 | D. | 该反应属于化合反应 |
 CH4、H2和CO(简称试验气)三种可燃性气体,可分别让他们在氧气中燃烧,把燃烧后生成的气体依次通过A、B两个洗气瓶.回答下列问题:
CH4、H2和CO(简称试验气)三种可燃性气体,可分别让他们在氧气中燃烧,把燃烧后生成的气体依次通过A、B两个洗气瓶.回答下列问题: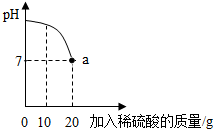 实验室有一瓶标签被腐蚀的稀硫酸溶液,小丽为了测定该稀硫酸溶液中溶质的质量分数,在烧杯中配制了16g10%的氢氧化钠溶液,然后往烧杯中滴加该稀硫酸溶液.反应过程中该溶液的pH与滴入稀硫酸溶液的质量关系如图所示.请回答下列的问题:
实验室有一瓶标签被腐蚀的稀硫酸溶液,小丽为了测定该稀硫酸溶液中溶质的质量分数,在烧杯中配制了16g10%的氢氧化钠溶液,然后往烧杯中滴加该稀硫酸溶液.反应过程中该溶液的pH与滴入稀硫酸溶液的质量关系如图所示.请回答下列的问题: 水是我们生活中重要物质.请用学过的知识回答下列有关水的问题:
水是我们生活中重要物质.请用学过的知识回答下列有关水的问题: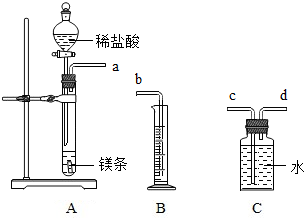 一定质量的镁与足量盐酸反应,用排水法测量产生氢气的体积,查密度表求出氢气的质量,再根据化学方程式计算出镁的相对原子质量.请利用如图给定仪器组装一套测定镁的相对原子质量的实验装置(每种仪器只用一次),并回答相关问题.
一定质量的镁与足量盐酸反应,用排水法测量产生氢气的体积,查密度表求出氢气的质量,再根据化学方程式计算出镁的相对原子质量.请利用如图给定仪器组装一套测定镁的相对原子质量的实验装置(每种仪器只用一次),并回答相关问题.