题目内容
15.金属是用途广泛的材料,根据相关信息回答以下问题:(1)金属大多存在于矿石中,如铁存在于赤铁矿(含Fe2O3),磁铁矿(含Fe3O4)、菱铁矿(含碳酸亚铁,化学式为FeCO3),铜存在于黄铜矿(含CuFeS2)、辉铜矿(含Cu2S,其中硫是负二价,则其名称为硫化亚铜)等.磁铁矿常用于工业炼铁,反应的化学方程式是Fe3O4+4CO$\frac{\underline{\;高温\;}}{\;}$4CO2+3Fe;Fe3O4在组成上可看成Fe2O3FeO(纯净物),它能与盐酸反应生成一种使溶液呈黄色的物质和一种使溶液呈清稿 绿色的物质,试用一个化学方程式表示该反应Fe3O4+8HCl$\frac{\underline{\;高温\;}}{\;}$2FeCl3+FeCl2+4H2O.
(2)斌斌同学准备在实验室中以碱式碳酸铜、铁粉、稀盐酸为原料来制取铜.设计实验流程如下:
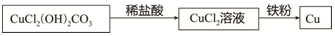
请回答以下问题:
①碱式碳酸铜中含有4种元素.
②碱式碳酸铜受热分解生成三种常见的氧化物,其中有一种通常是黑色固体,请写出该黑色,固体与木炭发生反应的化学方程式2CuO+C$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑.
碱式碳酸铜与稀盐酸反应的化学方程式Cu2(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O.预测实验现象:绿色固体逐渐消失,有大量气泡产生,溶液由无色变蓝色.
③若孔雀石样品中含有44.4gCu2(OH)2CO3,充分反应后,理论上能得到铜的质量为25.6g.
分析 (1)根据化学式的写法,化学方程式的书写方法,常见元素的化合价分析;
(2)根据已知条件,碱和碳酸盐的化学性质,根据化学反应预测实验现象及据化学反应计算物质的量,是解答此题的关键.
解答 解:(1)碳酸亚铁中的铁元素显正二价,碳酸根显负二价,故化学式为FeCO3;辉铜矿中硫是负二价,则铜显正一价,为亚铜,故名称为硫化亚铜;磁铁矿用于工业炼铁的反应原理为:Fe3O4+4CO$\frac{\underline{\;高温\;}}{\;}$4CO2+3Fe;溶液呈黄色的为氯化铁,溶液呈浅绿色的为氯化亚铁,故方程式为:Fe3O4+8HCl$\frac{\underline{\;高温\;}}{\;}$2FeCl3+FeCl2+4H2O;
故答案为:FeCO3;硫化亚铜;Fe3O4+4CO$\frac{\underline{\;高温\;}}{\;}$4CO2+3Fe;Fe3O4+8HCl$\frac{\underline{\;高温\;}}{\;}$2FeCl3+FeCl2+4H2O;
(2)①据碱式碳酸铜的化学式[Cu2(OH)2CO3],碱式碳酸铜中含有铜、氧、氢、碳4中元素;
②据已知条件碱式碳酸铜[Cu2(OH)2CO3],碱式碳酸铜受热分解生成三种常见的氧化物,故推测生成的三中氧化物为:水、二氧化碳、氧化铜,黑色固体为氧化铜,与木炭发生反应的化学方程式为:2CuO+C$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑;据已知条件碱式碳酸铜[Cu2(OH)2CO3]是一种绿色的不溶于水的固体,及碱式碳酸铜与稀盐酸反应的化学方程式为Cu2(OH)2CO3+4HCl═2CuCl2+CO2↑+3H2O,可推测因有二氧化碳生成,故有大量气泡产生,反应前碱式碳酸铜是一种绿色的不溶于水的固体,完全反应后生成溶于水的氯化铜,氯化铜溶于为蓝色,故为绿色固体逐渐消失,溶液由无色变蓝色,故预测实验现象为:绿色固体逐渐消失,有大量气泡产生,溶液由无色变蓝色;
③据反应Cu2(OH)2CO3+4HCl═2CuCl2+CO2↑+3H2O,CuCl2+Fe$\frac{\underline{\;\;△\;\;}}{\;}$FeCl2+Cu,从理论上其对应关系为:
Cu2(OH)2CO3→2Cu,设44.4g Cu2(OH)2CO3,充分反应后,理论上能得到铜的质量为x,则
Cu2(OH)2CO3→2Cu
222 128
44.4g x
x=$\frac{128×44.4g}{222}$=25.6g
故答案为:
①4;
②2CuO+C$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑;绿色固体逐渐消失,有大量气泡产生,溶液由无色变蓝色;
③25.6.
点评 化学实验现象是化学实验最突出、最鲜明的部分,也是进行分析推理得出结论的依据,掌握物质的性质和相互之间的反应关系,有助于提高观察实验、进行实验的能力.

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案| A. | 向左、右两烧杯中分别加入相等质量的Fe、CaO,反应后盐酸有剩余 | |
| B. | 向左、右两烧杯中分别加入相等质量的Al、Zn,两种金属完全溶解 | |
| C. | 向左、右两烧杯中分别加入相等质量的Mg、Al,反应后两种金属均有剩余 | |
| D. | 向左、右两烧杯中分别加入5.6 g Fe和1.8 g Al,两种金属完全溶解 |
| 时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
| 氧气体积/cm3 | 0 | 48 | 70 | 82 | 88 | 88 |
| 平均反应速率/cm3 s-1 | 0.0 | 2.4 | 1.1 | ① 0.6 | 0.3 | 0.0 |
(1)上述表格中①代表的数据是0.6
(2)如果重做以上实验,并用1.0g MnO2做催化剂,最终产生的氧气总量会如何变化?不变(填“增大”、“减少”或“不变”)理由是二氧化锰能够改变过氧化氢的分解速率,而与最终产生氧气的总质量无关,两次过氧化氢质量相等,因此产生氧气质量相等
(3)该实验条件下,最终产生的氧气质量是0.12克.(结果保留两位小数)
 如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了.则液体A和气体B的组合可能是下列的( )
如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了.则液体A和气体B的组合可能是下列的( )| A. | 氢氧化钙溶液、一氧化碳 | B. | 硝酸银、氯化氢 | ||
| C. | 酒精、氧气 | D. | 水、甲烷 |

| A. | ①稀硫酸②硫酸汞 | B. | ①稀盐酸 ②硫酸锌 | ||
| C. | ①稀盐酸 ②硫酸亚铁 | D. | ①稀硫酸 ②氯化镁 |
| A. | 是一种有机化合物 | |
| B. | 由四种元素组成 | |
| C. | 每个分子中含有31个原子 | |
| D. | 在这种物质中碳、氧两种元素质量比为16:1 |
| A. | 112:81:28 | B. | 336:27:84 | C. | 324:135:36 | D. | 56:81:56 |
| A. | NaO | B. | Cl2Fe | C. | HSO4 | D. | KNO3 |
 为测定空气中氧气的含量,某同学设计如下方案:选用实际容积为40mL的试管作反应容器,将过量的白磷放入试管,用橡皮塞塞紧试管,通过导管与实际容积为60mL且润滑性很好的针筒注射器组成实验装置,活塞前沿稳定在20mL刻度处(如图所示).假设此实验能够按照该同学的设想正常进行,且白磷所占体积与导管内的气体体积忽略不计,请回答下列问题:
为测定空气中氧气的含量,某同学设计如下方案:选用实际容积为40mL的试管作反应容器,将过量的白磷放入试管,用橡皮塞塞紧试管,通过导管与实际容积为60mL且润滑性很好的针筒注射器组成实验装置,活塞前沿稳定在20mL刻度处(如图所示).假设此实验能够按照该同学的设想正常进行,且白磷所占体积与导管内的气体体积忽略不计,请回答下列问题: