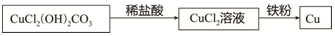
题目内容
6.二氧化锰可以用来催化过氧化氢的分解:现将0.5g MnO2加入50mL过氧化氢溶液中,收集产生的氧气(该实验条件下,氧气的密度是1.33g/L),每20s 记录所收集的气体体积并记录在表中:| 时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
| 氧气体积/cm3 | 0 | 48 | 70 | 82 | 88 | 88 |
| 平均反应速率/cm3 s-1 | 0.0 | 2.4 | 1.1 | ① 0.6 | 0.3 | 0.0 |
(1)上述表格中①代表的数据是0.6
(2)如果重做以上实验,并用1.0g MnO2做催化剂,最终产生的氧气总量会如何变化?不变(填“增大”、“减少”或“不变”)理由是二氧化锰能够改变过氧化氢的分解速率,而与最终产生氧气的总质量无关,两次过氧化氢质量相等,因此产生氧气质量相等
(3)该实验条件下,最终产生的氧气质量是0.12克.(结果保留两位小数)
分析 (1)根据上述表格中的数据可以进行相关方面的计算;
(2)催化剂能够改变化学反应的速率,而与最终产生氧气质量多少无关;
(3)氧气质量=氧气密度×氧气体积.
解答 解:(1)上述表格中①代表的数据是:(82-70)÷20=0.6,
故填:0.6.
(2)如果重做以上实验,并用1.0gMnO2做催化剂,最终产生的氧气总量不变,理由是:二氧化锰能够改变过氧化氢的分解速率,而与最终产生氧气的总质量无关,两次过氧化氢质量相等,因此产生氧气质量相等.
故填:不变;二氧化锰能够改变过氧化氢的分解速率,而与最终产生氧气的总质量无关,两次过氧化氢质量相等,因此产生氧气质量相等.
(3)该实验条件下,最终产生的氧气质量是:1.33g/L×0.088L=0.12g,
故填:0.12.
点评 催化剂能够改变化学反应的速率,而本身质量和化学性质在反应前后都不变,要注意理解.

练习册系列答案
相关题目
1.现有A、B两种银白色的金属,某同学想要探究这两种金属的活动性.
【设计实验】
取大小相同的两块金属,用砂纸打磨光亮,分别放入两支试管中,再加入等量的同种稀盐酸,操作与现象如表:
【思考结论】
(1)通过上述实验,判断出两种金属的活动性是A<B(填“>”或“<”).
(2)如果两种金属是镁和铁,还可以用镁和一种化合物的溶液来证明两者的金属活动性强弱,你认为该化合物可以是FeSO4(填化学式).
【设计实验】
取大小相同的两块金属,用砂纸打磨光亮,分别放入两支试管中,再加入等量的同种稀盐酸,操作与现象如表:
| 实验 | 试管1 | 试管2 |
| 操作 |  |  |
| 现象 | 金属表面产生气泡较慢 | 金属表面产生气泡较快 |
(1)通过上述实验,判断出两种金属的活动性是A<B(填“>”或“<”).
(2)如果两种金属是镁和铁,还可以用镁和一种化合物的溶液来证明两者的金属活动性强弱,你认为该化合物可以是FeSO4(填化学式).
11. 反应物的温度、浓度、固体反应物的颗粒大小等因素会影响化学反应速率.为研究实验室制取二氧化碳的适宜条件,进行如下四组实验:
反应物的温度、浓度、固体反应物的颗粒大小等因素会影响化学反应速率.为研究实验室制取二氧化碳的适宜条件,进行如下四组实验:
(1)大理石与盐酸反应的化学方程式是CaCO3+2HCl═CaCl2+H2O+CO2↑.
(2)实验甲与丙对照(填编号),是为了研究固体反应物颗粒大小对反应速率的影响.
(3)上述实验中,另一个影响反应速率的因素是盐酸的质量分数.
(4)如表是小明同学按照乙组进行实验测定生成二氧化碳体积的实验数据.
请解释大理石与稀盐酸反应速率逐渐减慢的原因盐酸溶液的质量分数减少.
(5)除去二氧化碳气体中混有的氯化氢气体,选用图中的B(填字母,下同),将混合气体从d端通入.
(6)请完成探究温度对反应速率影响的数据
 反应物的温度、浓度、固体反应物的颗粒大小等因素会影响化学反应速率.为研究实验室制取二氧化碳的适宜条件,进行如下四组实验:
反应物的温度、浓度、固体反应物的颗粒大小等因素会影响化学反应速率.为研究实验室制取二氧化碳的适宜条件,进行如下四组实验:| 甲 | 乙 | 丙 | 丁 | |
| 大理石/(等量) | 块状 | 块状 | 粉末状 | 粉末状 |
| 盐酸/(质量分数) | 5% | 10% | 5% | 10% |
| 收集50mL二氧化碳所需时间/(秒) | 118 | 60 | 70 | 50 |
(2)实验甲与丙对照(填编号),是为了研究固体反应物颗粒大小对反应速率的影响.
(3)上述实验中,另一个影响反应速率的因素是盐酸的质量分数.
(4)如表是小明同学按照乙组进行实验测定生成二氧化碳体积的实验数据.
| 时段 | 第10秒 | 第20秒 | 第30秒 | 第40秒 | 第50秒 | 第60秒 |
| CO2体积 | 13 | 11 | 9 | 8 | 5 | 4 |
(5)除去二氧化碳气体中混有的氯化氢气体,选用图中的B(填字母,下同),将混合气体从d端通入.
(6)请完成探究温度对反应速率影响的数据
| 甲 | 乙 | |
| 大理石/(等量) | 块状 | 块状 |
| 盐酸/(质量分数) | 10% | 10% |
| 盐酸质量/(g) | 100 | 100 |
| 盐酸温度/℃ | 20 | 30 |
18.某同学需测定某100g过氧化氢溶液中所含过氧化氢的质量.他取10g二氧化锰放入烧杯中,并将该过氧化氢溶液全部加入,不同时间用电子天平测量其质量,所得读数如表所示:
(1)试分析,100g过氧化氢溶液完全反应后生成氧气的质量为3.2g.
(2)计算100g过氧化氢溶液中过氧化氢质量分数为多少?(写出计算过程)
| 反应时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
| 烧杯及所盛物质总质量/g | 335.70 | 334.30 | 334.00 | 333.50 | 333.00 | 332.50 | 332.50 |
(2)计算100g过氧化氢溶液中过氧化氢质量分数为多少?(写出计算过程)
16.下表表示一杯刚配制的饱和硝酸钾溶液和硝酸钾在不同温度时的溶解度,要增加该溶液的溶质质量分数,下列操作正确的是( )
| 温度(℃) | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 溶解度(克) | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110.0 | 138 | 169 |
| A. | 升温 | B. | 降温 | C. | 加糖 | D. | 搅拌 |