题目内容
7.某燃料X 在7.2g 氧气中燃烧,得到9.2g 混合气体(可能含有一氧化碳、二氧化碳、水蒸气).化学兴趣小组的同学利用下图所示装置验证混合气体的成分.
请回答下列问题:
(1)通过混合气体后,A 装置增重4.5g,B 装置中澄清石灰水变浑浊,说明混合气体中含有水蒸气和二氧化碳.
(2)D 装置的作用是检验二氧化碳是否除尽.
(3)当观察到E中红色固体变黑,F中石灰水变浑浊,证明混合气体中有CO.
(4)实验结束后,同学们称量B、C 装置共增重3.3g,根据以上数据可确定燃料X 中所含元素为C、H,其质量比为3:1.
分析 (1)根据浓硫酸有吸水性、二氧化碳能使澄清的石灰水变浑浊进行分析;
(2)澄清的石灰水可以检验二氧化碳;
(3)根据一氧化碳具有还原性分析实验现象;
(4)根据B、C装置可以吸收二氧化碳,增重的质量即为二氧化碳的质量,据此计算元素的质量比.
解答 解:(1)浓硫酸有吸水性,因此浓硫酸增重就说明吸收了水,因此混合气体中含有水蒸气;B装置中澄清石灰水变浑浊,说明含有二氧化碳;
(2)D装置的澄清石灰水可以检验氢氧化钠溶液是否吸收尽二氧化碳,便于对一氧化碳产生二氧化碳的检验;
(3)一氧化碳具有还原性,可以和氧化铁反应产生铁和二氧化碳,因此观察到的现象是红色固体变成黑色,F中石灰水变浑浊;
(4)B、C装置可以吸收二氧化碳,增重的质量即为二氧化碳的质量,说明二氧化碳的质量为3.3g,因为混合气体质量为9.2g,其中水蒸气为4.5g、3.3g二氧化碳,则生成一氧化碳的质量为1.4g,4.5g水中氢元素的质量为4.5g×$\frac{2}{18}$×100%=0.5g,3.3g二氧化碳中碳元素的质量为3.3g×$\frac{12}{44}$×100%=0.9g,1.4g一氧化碳中碳元素的质量为1.4g×$\frac{12}{28}$×100%=0.6g,根据质量守恒定律燃料X的质量为9.2g-7.2g=2g,碳元素和氧元素的质量和为0.9g+0.6g+0.5g=2g,因此X中不含有氧元素,只含有碳、氢元素,因此两种元素的质量比为:(0.9g+0.6g):0.5g=3:1;
故答案为:
(1)水蒸气和二氧化碳;
(2)检验二氧化碳是否除尽;
(3)E中红色固体变黑,F中石灰水变浑浊;
(4)C、H;3:1
点评 本题以实验探究的形式考查常见气体氢气、一氧化碳、二氧化碳和水蒸气的性质,同学们要具有综合的化学知识才能做好此题.

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案( )
| A. | 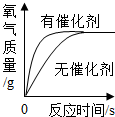 用等质量、等浓度的过氧化氢溶液在有无催化剂条件下制氧气 用等质量、等浓度的过氧化氢溶液在有无催化剂条件下制氧气 | |
| B. | 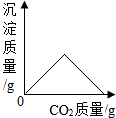 表示澄清石灰水中持续通入CO2 表示澄清石灰水中持续通入CO2 | |
| C. | 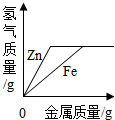 向等质量、等浓度的稀硫酸中分别逐渐加入锌粉和铁粉 向等质量、等浓度的稀硫酸中分别逐渐加入锌粉和铁粉 | |
| D. | 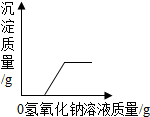 向一定质量的氯化铜和稀盐酸的混合溶液中逐滴加入氢氧化钠溶液 向一定质量的氯化铜和稀盐酸的混合溶液中逐滴加入氢氧化钠溶液 |
| A. | 用碳酸氢钠焙制糕点 | |
| B. | 饮用牛奶和豆浆可以缓解重金属引起的中毒 | |
| C. | 医疗上用酒精杀菌消毒 | |
| D. | 用甲醛溶液对水产品保鲜 |
 地壳中含有丰富的氧、硅、铝、铁等元素.结合如图分析,关于这四种元素的说法错误的是( )
地壳中含有丰富的氧、硅、铝、铁等元素.结合如图分析,关于这四种元素的说法错误的是( )| A. | 氧原子的核电荷数为8 | |
| B. | 硅元素属于非金属元素 | |
| C. | 铝与氧元素形成化合物的化学式为A1203 | |
| D. | 铁的相对原子质量为55.85g |
 如图是配制好的盐酸溶液的标签,请根据标签上的文字信息,进行计算:某纯碱样品中含有少量氯化钠.为测定样品中碳酸钠的质量分数,现称取该样品11.0g,放入烧杯中加水完全溶解后滴加上述配制的盐酸溶液至完全反应,最后测得生成气体的质量为4.4g,计算:
如图是配制好的盐酸溶液的标签,请根据标签上的文字信息,进行计算:某纯碱样品中含有少量氯化钠.为测定样品中碳酸钠的质量分数,现称取该样品11.0g,放入烧杯中加水完全溶解后滴加上述配制的盐酸溶液至完全反应,最后测得生成气体的质量为4.4g,计算: