题目内容
19.实验和生产过程应尽量减少对环境的负面作用.以下符合这一思想的是( )| A. | 实验室中氯化钡废液可直接排入下水道 | |
| B. | 利用2Cu+O2+2H2SO4(稀)═2CuSO4+2H2O的反应由铜制取胆矾 | |
| C. | 在煤矿附近建发电厂有利于减少二氧化硫排放 | |
| D. | 用废旧塑料制食品包装袋以减少“白色污染” |
分析 A.废液可能腐蚀下水道并造成二次污染;
B、根据由铜制取胆矾的原理解答;
C、根据煤燃烧产生二氧化硫解答;
D、根据造成白色污染的原因解答.
解答 解:A.将实验室的废液直接倒入下水道,可能腐蚀下水道并造成二次污染,故错误;
B、利用2Cu+O2+2H2SO4(稀)═2CuSO4+2H2O的反应由铜制取胆,故正确;
C、在煤矿附近建发电厂,煤燃烧产生二氧化硫,不能减少二氧化硫排放,故错误;
D、用废旧塑料制食品包装袋,不能减少“白色污染”,故错误.
答案:B.
点评 本题考查学生关注化学与工农业生产、日常生活、社会热点问题,为高考常见题型,有利于培养学生良好的科学素养,提高学习的积极性,注意相关基础知识的积累,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.如图所示,王欢同学操作正确的是( )
| A. |  | B. |  | C. |  | D. |  |
7.判断镁条燃烧是化学变化的依据的现象是( )
| A. | 剧烈燃烧,发出耀眼的白光 | B. | 放出大量的热 | ||
| C. | 生成了白色固体 | D. | 生成了氧化镁 |
8.某实验小组利用废硫酸液制备K2SO4
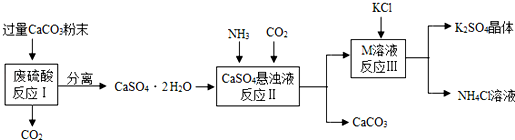
(1)将CaCO3研成粉末的目的是与硫酸充分反应.
(2)上述流程中可循环使用的物质有CO2和CaCO3(填写化学式).
(3)反应Ⅲ中相关物质的溶解度如下表.你认为反应Ⅲ在常温下能实现的原因是常温下硫酸钾的溶解度远小于氯化铵的溶解度.
(4)不用水而用饱和K2SO4溶液洗涤反应Ⅲ所得晶体的目的是防止硫酸钾流失;为检验此晶体是否洗涤干净,可取最后一次洗涤液,先加入b(选填序号,下同),振荡、静置,再向上层清液中滴加a,观察现象即可判断.
a.AgNO3溶液 b.过量的BaCl2溶液 c.过量的Ba(NO3)2溶液.

(1)将CaCO3研成粉末的目的是与硫酸充分反应.
(2)上述流程中可循环使用的物质有CO2和CaCO3(填写化学式).
(3)反应Ⅲ中相关物质的溶解度如下表.你认为反应Ⅲ在常温下能实现的原因是常温下硫酸钾的溶解度远小于氯化铵的溶解度.
| 物质 | KCl | K2SO4 | NH4Cl | M |
| 溶解度/g(25℃) | 34.0 | 11.1 | 37.2 | 19.5 |
a.AgNO3溶液 b.过量的BaCl2溶液 c.过量的Ba(NO3)2溶液.

 自行车的主要材料钢铁易生锈,请为图中标示的自行车部件各设计一种不同的、合理的防锈方法.
自行车的主要材料钢铁易生锈,请为图中标示的自行车部件各设计一种不同的、合理的防锈方法.
 如图是电解水实验的示意图:
如图是电解水实验的示意图: