题目内容
6.某兴趣小组的同学从实验室收集含有FeSO4、CuSO4的废液,他们向从中回收金属铜和硫酸亚铁晶体,设计如图实验方案.
(1)写出步骤①中反应的化学方程式.
(2)步骤②中,加入过量稀硫酸的目的是什么?
(3)从滤液中获得硫酸亚铁晶体采用的方法是什么?
分析 (1)由于目的是获得铜单质和硫酸亚铁,所以需要将铜离子转化为铜单质,而溶液中需要的是硫酸亚铁而不能引入新的杂质,所以加入的能够将铜离子转化为铜单质的只能是单质铁;
(2)由于加入的铁是过量的,加入过量稀硫酸的目的是除去铜中的铁;
(3)蒸发从溶液中获得晶体常采用的方法.
解答 解:(1)由题意可知,由于需要将铜离子转化为铜单质,而溶液还必须为硫酸亚铁,即不能引入新的杂质,所以可以加入铁将铜离子转化为铜单质.该反应的化学方程式为:Fe+CuSO4=FeSO4 +Cu;
(2)由上述分析可知,在步骤①中有加入的过量的铁,所以步骤②中,加入过量稀硫酸的目的是:使铁完全反应,除去铜中的铁;
(3)由于滤液中含有稀硫酸,应先加入过量的铁粉,再过滤,将滤液进行蒸发可获得硫酸亚铁晶体.
故答为:(1)铁,Fe+CuSO4 =FeSO4 +Cu;(2)使铁完全反应,除去铜中的铁;(3)加入过量的铁粉,再过滤,将滤液进行蒸发可获得硫酸亚铁晶.
点评 解答本题时要注意混合物的分离要考虑为彻底分开而加入过量试剂,所以后一环节需要将之除去.

练习册系列答案
相关题目
17.正确的实验操作对实验结果、人身安全都非常重要.下列实验操作正确的是( )
| A. |  测定溶液的pH | B. |  取用液体 | ||
| C. |  加热液体 | D. |  清洗试管 |
18.下列有关实验操作正确的是( )
| A. |  装药品 | B. |  浓硫酸稀释 | C. |  量取8.5mL液体 | D. |  称量氢氧化钠 |
15.酸、碱、盐在工农业生产和日常生活中应用广泛,下列做法错误的是( )
| A. | 用食盐水除去水壶中的水垢 | |
| B. | 用石灰乳与硫酸铜溶液配制农药波尔多液 | |
| C. | 用稀盐酸除去铁制品表面的铁锈 | |
| D. | 施用复合肥硝酸钾能使作物枝叶繁茂,并增加抗倒伏能力 |
16.陕西省礼泉县盛产苹果,苹果中的苹果酸(C4H4O4)有消除疲劳,迅速恢复体力的作用.下列有关说法正确的是( )
| A. | 苹果中富含的有机营养素是蛋白质 | |
| B. | 苹果酸分子由C、H、O三种元素构成 | |
| C. | 苹果酸中碳元素质量分数约为41.4% | |
| D. | 苹果酸属于氧化物 |
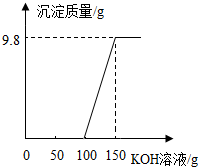 电镀厂的废水中含有H2SO4和CuSO4,为了回收CuSO4并得到化肥,工厂化验室取来一定量废水,逐滴加入KOH溶液,反应情况如图所示,请回答:
电镀厂的废水中含有H2SO4和CuSO4,为了回收CuSO4并得到化肥,工厂化验室取来一定量废水,逐滴加入KOH溶液,反应情况如图所示,请回答: 物质的性质和用途是化学的重要研究内容.
物质的性质和用途是化学的重要研究内容. 如图是甲、乙两种固体物质的溶解度曲线.t1℃时,将5g乙加到10g水中可得到12g溶液;t3℃时,甲、乙各100g饱和溶液降温至t2℃,析出固体多的是甲;将t3℃时150g甲的饱和溶液稀释为20%,需加水100g.
如图是甲、乙两种固体物质的溶解度曲线.t1℃时,将5g乙加到10g水中可得到12g溶液;t3℃时,甲、乙各100g饱和溶液降温至t2℃,析出固体多的是甲;将t3℃时150g甲的饱和溶液稀释为20%,需加水100g.