题目内容
18.如图所示,甲、乙、丙、丁、戊分别是纯碱溶液、氯化钡溶液、氧化铁、熟石灰和稀盐酸中的一种,图中短线相连的物质能相互发生反应.已知乙溶液能使紫色石蕊溶液变成红色.
(1)甲物质为Ca(OH)2,戊物质为BaCl2(填化学式).
(2)甲和丙反应的化学方程式是Ca(OH)2+Na2CO3=CaCO3↓+2NaOH.
(3)丙与丁反应的化学方程式是6HCl+Fe2O3=2FeCl3+3H2O.
(4)向盛有乙溶液的烧杯中滴加甲溶液,烧杯中溶液的pH会增大(增大或减小),该反应的基本反应类型为复分解反应.
分析 根据甲、乙、丙、丁、戊分别是纯碱溶液、氯化钡溶液、氧化铁、熟石灰和稀盐酸中的一种,乙溶液能使紫色石蕊溶液变成红色,所以乙是稀盐酸,稀盐酸会与碳酸钠、氧化铁、氢氧化钙反应,所以戊是氯化钡,氯化钡会与碳酸钠反应,所以丙是碳酸钠,碳酸钠不会与氧化铁反应,所以丁是氧化铁,甲是氢氧化钙,然后将推出的物质进行验证即可.
解答 解:甲、乙、丙、丁、戊分别是纯碱溶液、氯化钡溶液、氧化铁、熟石灰和稀盐酸中的一种,乙溶液能使紫色石蕊溶液变成红色,所以乙是稀盐酸,稀盐酸会与碳酸钠、氧化铁、氢氧化钙反应,所以戊是氯化钡,氯化钡会与碳酸钠反应,所以丙是碳酸钠,碳酸钠不会与氧化铁反应,所以丁是氧化铁,甲是氢氧化钙,
经过验证,推导正确,因此:
(1)甲是氢氧化钙,戊是氯化钡;故填:Ca(OH)2;BaCl2;
(2)甲和丙的反应是碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,故化学方程式是:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;
(3)氧化铁和盐酸反应生成氯化铁和水,故化学方程式是:6HCl+Fe2O3=2FeCl3+3H2O;
(4)向盛有盐酸的烧杯中滴加氢氧化钙溶液,烧杯中溶液的pH会增大,该反应属于复分解反应;故填:增大;复分解反应.
点评 在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可.

练习册系列答案
相关题目
13.下列物质溶于水pH>7的是( )
| A. | 水 | B. | 氯化钠 | C. | 硫酸 | D. | 氢氧化钠 |
13.下列图象中,能正确反映其对应变化关系的是( )
| A. |  服用胃舒平[主要成分是Al(OH)3]治疗胃酸过多,胃液pH的变化 | |
| B. |  向一定质量的稀盐酸和氯化铜的混合溶液中加入氢氧化钠溶液 | |
| C. |  将等质量的镁和铁分别投入到盛有足量同种稀硫酸的两个容器中 | |
| D. |  浓盐酸敞口放置 |
3.下列图象能正确反映对应变化关系的是( )
| A. |  形状和质量相同的铁和锌分别加入到足量的同一种稀硫酸中 | |
| B. |  加热一定质量氯酸钾和二氧化锰混合固体 | |
| C. |  CaCl2和HCl混合液中加碳酸钠钠溶液 | |
| D. |  饱和KNO3溶液加水稀释 |
10. 将NaOH溶液逐滴滴入一定量的H2SO4和CuSO4混合溶液中,滴加NaOH溶液质量与生成沉淀质量的关系如图所示,下列说法正确的是( )
将NaOH溶液逐滴滴入一定量的H2SO4和CuSO4混合溶液中,滴加NaOH溶液质量与生成沉淀质量的关系如图所示,下列说法正确的是( )
 将NaOH溶液逐滴滴入一定量的H2SO4和CuSO4混合溶液中,滴加NaOH溶液质量与生成沉淀质量的关系如图所示,下列说法正确的是( )
将NaOH溶液逐滴滴入一定量的H2SO4和CuSO4混合溶液中,滴加NaOH溶液质量与生成沉淀质量的关系如图所示,下列说法正确的是( )| A. | a点处溶液的溶质是Na2SO4和 CuSO4 | |
| B. | ab段表示NaOH和H2SO4反应 | |
| C. | 往c点处溶液中滴加酚酞溶液,溶液不变色 | |
| D. | 整个过程中,溶液中氢元素的质量逐渐变小 |
7. 据报道,科学家已制备出目前世界上最细的纳米电线,纳米电线内铜原子和硫原子位于中间,金刚石为基体的结构处于绝缘外层,将其紧紧捆住,这种导线已达到不用显微镜就不可以看见的长度了,关于纳米电线线路说法正确的是( )
据报道,科学家已制备出目前世界上最细的纳米电线,纳米电线内铜原子和硫原子位于中间,金刚石为基体的结构处于绝缘外层,将其紧紧捆住,这种导线已达到不用显微镜就不可以看见的长度了,关于纳米电线线路说法正确的是( )
 据报道,科学家已制备出目前世界上最细的纳米电线,纳米电线内铜原子和硫原子位于中间,金刚石为基体的结构处于绝缘外层,将其紧紧捆住,这种导线已达到不用显微镜就不可以看见的长度了,关于纳米电线线路说法正确的是( )
据报道,科学家已制备出目前世界上最细的纳米电线,纳米电线内铜原子和硫原子位于中间,金刚石为基体的结构处于绝缘外层,将其紧紧捆住,这种导线已达到不用显微镜就不可以看见的长度了,关于纳米电线线路说法正确的是( )| A. | 纳米电线内的铜原子和硫原子都不再运动 | |
| B. | 这种导线是混合物 | |
| C. | 构成它的原子都是由金属原子构成的 | |
| D. | 它的原子之间紧密结合不再有间隔 |
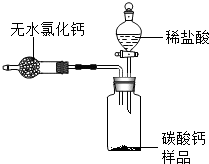 为测定某市售碳酸钙药品中碳酸钙的质量分数(杂质为SiO2,与稀盐酸不反应),某同学设计了如下实验方案(已知:无水氯化钙是常见的干燥剂):
为测定某市售碳酸钙药品中碳酸钙的质量分数(杂质为SiO2,与稀盐酸不反应),某同学设计了如下实验方案(已知:无水氯化钙是常见的干燥剂): 探究实验室制取气体的方法
探究实验室制取气体的方法