题目内容
12.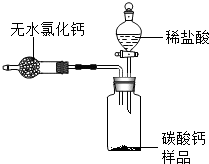 为测定某市售碳酸钙药品中碳酸钙的质量分数(杂质为SiO2,与稀盐酸不反应),某同学设计了如下实验方案(已知:无水氯化钙是常见的干燥剂):
为测定某市售碳酸钙药品中碳酸钙的质量分数(杂质为SiO2,与稀盐酸不反应),某同学设计了如下实验方案(已知:无水氯化钙是常见的干燥剂):a.按图组装好装置,检查装置气密性后,在分液漏斗中加入过量稀盐酸,并在干燥管中加入适量无水氯化钙样品,称得装置和药品的总质量为564.57g;
b.在广口瓶中加入碳酸钙样品,称得装置和药品的总质量为574.57g;
c.旋紧橡皮塞,打开分液漏斗旋塞,向广口瓶中滴加稀盐酸,使样品与稀盐酸完全反应;
d.反应结束后,称得装置及装置内所有物质的总质量为570.57g.
请根据上述实验回答下列问题:
(1)该方案测得样品中碳酸钙的质量分数是多少(写出解题过程)?
(2)若实验中不用无水氯化钙干燥,则测得样品中碳酸钙的质量分数与上述实验计算结果相比偏大(选填“偏小”、“不变”或“偏大”).
分析 碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,根据反应的化学方程式及其提供的数据可以进行相关方面的计算和判断.
解答 解:(1)样品的质量为:574.57g-564.57g=10g,
生成二氧化碳的质量为:574.57g-570.57g=4g,
设参加反应的碳酸钙的质量为x,
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 44
x 4g
$\frac{100}{x}$=$\frac{44}{4g}$,
x=9.09g,
所以碳酸钙样品中碳酸钙的质量分数为:$\frac{9.09g}{10g}$×100%=90.9%,
答:所以碳酸钙样品中碳酸钙的质量分数是90.9%.
(2)若实验中不用无水氯化钙干燥,则部分水蒸气随着二氧化碳逸出,导致计算出的二氧化碳质量偏大,从而导致测得样品中碳酸钙的质量分数与上述实验计算结果相比偏大.
故填:偏大.
点评 差量法在计算中的应用很广泛,解答的关键是要分析出物质的质量差与要求的未知数之间的关系,再根据具体的数据求解.

练习册系列答案
相关题目
20.物质的性质决定物质的用途,下列有关物质的用途是由其化学性质决定的是( )
| A. | 铜常用作导线 | B. | 干冰用于人工降雨 | ||
| C. | 氮气用作食品保护气 | D. | 金刚石用于切割大理石 |
17. 如表实验内容中的横、纵坐标表示的量符合如图所示变化趋势的是( )
如表实验内容中的横、纵坐标表示的量符合如图所示变化趋势的是( )
 如表实验内容中的横、纵坐标表示的量符合如图所示变化趋势的是( )
如表实验内容中的横、纵坐标表示的量符合如图所示变化趋势的是( ) | 序号 | 实验内容 | 横坐标表示的量 | 纵坐标表示的量 |
| ① | 盐酸加水稀释 | 加入水的体积 | 溶液的pH |
| ② | 过量红磷测定空气中氧气含量 | 时间 | 红磷质量 |
| ③ | 过氧化氢溶液与二氧化锰制氧气 | 时间 | 二氧化锰质量 |
| ④ | 向铜、锌混合物粉末中加入盐酸 | 盐酸质量 | 剩余固体质量 |
| A. | ①② | B. | ①④ | C. | ②③ | D. | ②④ |
4.下列化学方程式书写正确的是( )
| A. | Mg+O2$\frac{\underline{\;点燃\;}}{\;}$MgO2 | B. | 4Fe+3O2$\frac{\underline{\;点燃\;}}{\;}$2Fe2O3 | ||
| C. | 4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5 | D. | CH4+O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2 |
1.下列有关溶液的说法中,正确的是( )
| A. | 洗剂精可以溶解食用油 | |
| B. | 均一、稳定的液体都是溶液 | |
| C. | 溶质都以分子形式溶解在溶剂里 | |
| D. | 氢氧化钠溶于水,使溶液的温度升高 |

 根据如图回答问题:
根据如图回答问题: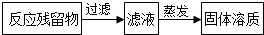 ,过滤所用的玻璃仪器除烧杯、漏斗外,还有玻璃棒(填仪器名称),在蒸发过程中,当蒸发皿中出现较多量固体时,停止加热,利用蒸发皿的余热使滤液蒸干.
,过滤所用的玻璃仪器除烧杯、漏斗外,还有玻璃棒(填仪器名称),在蒸发过程中,当蒸发皿中出现较多量固体时,停止加热,利用蒸发皿的余热使滤液蒸干.