题目内容
20.某化学兴趣小组进行研究性学习,探究热水壶中的水垢.【查阅资料】①天然水中一般都含有Ca2+、Mg2+、HCO3-等离子,在加热时,这些离子反应生成溶解度更小的物质-水垢[Mg(OH)2和CaCO3].②碱石灰是氧化钙和氢氧化钠的固体混合物.
【实验设计】

(一)按图组装仪器,将10.8g水垢样品放入装置B中,在装置D中加入一定量的稀盐酸溶液;
(二)将稀盐酸溶液缓缓滴入装置B中,与水垢充分反应;
(三)待实验不再产生气泡时,打开AB间活塞,从左端缓缓鼓入一定量的空气;
(四)吹扫一段时间后,测定到装置E质量增重了2.2g.
【分析数据】
(1)仪器a的名称分别是锥形瓶;
(2)鼓入空气的目的是产生的气体向右流动与装置C、E充分接触;装置A的作用是吸收空气中的CO2;装置C中体现浓硫酸的吸水性;
(3)写出实验中产生气体的化学反应方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑;
(4)水垢中Mg(OH)2的质量为5.8g.
分析 根据仪器写出名称即可;鼓入空气可以形成压力,使产生的二氧化碳全部排出B以利于被E吸收;氢氧化钠能吸收二氧化碳,浓硫酸具有吸水性;碳酸钙能与盐酸反应生成氯化钙、水和二氧化碳,根据二氧化碳的质量求出碳酸钙的质量,从而求出氢氧化钠的质量,据此解答.
解答 解:(1)据图可知a是锥形瓶,故填:锥形瓶;
(2)鼓入空气能使使产生的二氧化碳全部排出B以利于被E吸收,故填:产生的气体向右流动与装置C、E充分接触;
装置A中盛有的是氢氧化钠溶液,能吸收空气中的二氧化碳,防止对二氧化碳质量的测定造成干扰,故填:吸收空气中的CO2;
装置C盛装的是浓硫酸,浓硫酸具有吸水性,能吸收二氧化碳中含有的水蒸气,故填:吸水;
(3)碳酸钙能与盐酸反应生成氯化钙、水和二氧化碳,故填:CaCO3+2HCl=CaCl2+H2O+CO2↑;
(4)设碳酸钙的质量是x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 2.2g
$\frac{100}{x}=\frac{44}{2.2g}$
x=5g
故氢氧化镁的质量为:10.8g-5g=5.8g,故填:5.8g.
点评 本题考查了混合物成分的推断,完成此题,可以依据已有的知识结合题干提供的信息进行.

练习册系列答案
相关题目
7.化学实验中常涉及实验操作的先后顺序,下列实验操作不正确的是( )
| A. | 制取二氧化碳时,先检查装置的气密性,后装药品 | |
| B. | 氢气还原氧化铜时,先通一会氢气,后加热氧化铜 | |
| C. | 给试管中的物质加热时,先均匀加热,后集中在药品的部位加热 | |
| D. | 用排水法收集氧气时,先撤酒精灯,后撤导气管 |
9.某同学开始时视线与量筒内凹液面的最低处相平读数为12ml,倒出一部分液体后,俯视读取剩余液体为5ml,那么他所倒出液体体积为( )
| A. | 大于7ml | B. | 小于7ml | C. | 等于7ml | D. | 无法确定 |


 ”和“
”和“ ”分别表示氧原子和汞原子,如图是氧化汞在加热条件下发生分解反应的微观模拟图.请回答下列问题:
”分别表示氧原子和汞原子,如图是氧化汞在加热条件下发生分解反应的微观模拟图.请回答下列问题: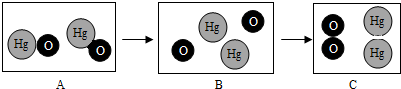
 如图是合肥市天鹅湖边矗立的“鱼水情”雕塑.雕塑高18米,用不锈钢板焊接而成. 雕塑以火红色调为主,体现合肥“双拥模范城”军民鱼水情深.
如图是合肥市天鹅湖边矗立的“鱼水情”雕塑.雕塑高18米,用不锈钢板焊接而成. 雕塑以火红色调为主,体现合肥“双拥模范城”军民鱼水情深.