题目内容
20.如表是Ca(OH)2和NaOH的溶解度数据.请回答下列问题:| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度/g | Ca(OH)2 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 |
| NaOH | 31 | 91 | 111 | 129 | 313 | 336 | |
(2)20℃时,NaOH的溶解度为91g.
(3)要想把一瓶接近饱和的Ca(OH)2溶液变成饱和溶液,具体的措施有:①加入氢氧化钙,②升高温度,③减低温度,④加入水,⑤蒸发水后再恢复到原温度,⑥加入生石灰.其中正确的是D.
A.②④⑥B.③④C.①③⑤⑥D.①②⑤⑥
(4)现将20℃时Ca(OH)2的饱和溶液甲溶液降温至0℃得到乙溶液,则两种溶液中溶质的质量分数相比,乙=(填“>”“<”或“=”)甲.
(5)现有60℃时含Ca(OH)2和NaOH两种溶质的饱和溶液,若要得到较纯净的NaOH晶体,应采取的物理方法是降温结晶并过滤.
分析 (1)根据表格中的数据判断;
(2)根据表格中20℃时,NaOH的溶解度解答;
(3)不饱和溶液变为饱和溶液的一般方法是:增加溶质,蒸发溶剂,降低温度,并结合Ca(OH)2的溶解度随温度变化情况分析解答;
(4)Ca(OH)2的溶解度随温度的升高而减小,并结合饱和溶液溶质的质量分数计算式分析解答;
(5)根据氢氧化钙的溶解度随温度的升高而减小,氢氧化钠的溶解度随温度的升高而增大判断;
解答 解:(1)从表格中的数据可知氢氧化钙的溶解度随温度的升高而减小;
(2)表格中14g20℃时,NaOH的溶解度为91g;
(3)Ca(OH)2的溶解度随温度的升高而减小,所以要使其不饱和溶液变为饱和溶液可采取增加溶质、蒸发溶剂、升温的方法,生石灰溶于水和水反应且放热使溶液温度升高,其溶解度减小,也可使不饱和溶液变为饱和溶液,故选D;
(4)Ca(OH)2的溶解度随温度的升高而减小,将20℃时Ca(OH)2的饱和溶液甲溶液降温至0℃得到乙溶液,此过程中溶液中溶质溶剂均未变化,所以
两种溶液中溶质的质量分数相等;
(5)氢氧化钙的溶解度随温度的升高而减小,氢氧化钠的溶解度随温度的升高而增大,降温氢氧化钠结晶析出,氢氧化钙溶解度增大不会结晶析出,然后过滤即可得到纯净的氢氧化钠;
故答案为:
(1)Ca(OH)2
(2)91g;(3)D;(4)=;(5)降温结晶并过滤
点评 了解Ca(OH)2、NaOH溶解度的溶解度随温度的变化情况,并能据所学知识正确分析解答,本题重在考查对知识的掌握和应用.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目
10.某化学兴趣小组对“怎样验证没有明显现象的化学反应是否发生”进行了如下探究.

[探究实验一]如图1所示,向左、右两管中同时逐滴滴加一定量的氢氧化钠稀溶液和稀盐酸,开始时左管溶液呈红色.一段时间后U型管中溶液全部呈无色,证明了氢氧化钠与稀盐酸发生了反应.请写出上述反应的化学方程式NaOH+HCl═NaCl+H2O.
[探究实验二]如图2所示,在两个体积相同的A、B软塑料瓶内先先充满CO2,然后分别倒入等体积的饱和NaOH溶液和水,迅速拧紧瓶盖振荡,可观察到A软塑料瓶明显变扁,证明了氢氧化钠与二氧化碳发生了反应.
(1)A中发生反应的化学方程式为CO2+2NaOH═Na2CO3+H2O.
(2)B瓶的作用是对比.
[探究实验三]
【反思拓展】通过此探究实验我们发现,对于没有明显现象的化学反应,可以从不同的角度证明反应的发生,这些角度可以是:
①可以借助酸碱指示剂证明反应的发生;
②通过检验生成物证明反应的发生.

[探究实验一]如图1所示,向左、右两管中同时逐滴滴加一定量的氢氧化钠稀溶液和稀盐酸,开始时左管溶液呈红色.一段时间后U型管中溶液全部呈无色,证明了氢氧化钠与稀盐酸发生了反应.请写出上述反应的化学方程式NaOH+HCl═NaCl+H2O.
[探究实验二]如图2所示,在两个体积相同的A、B软塑料瓶内先先充满CO2,然后分别倒入等体积的饱和NaOH溶液和水,迅速拧紧瓶盖振荡,可观察到A软塑料瓶明显变扁,证明了氢氧化钠与二氧化碳发生了反应.
(1)A中发生反应的化学方程式为CO2+2NaOH═Na2CO3+H2O.
(2)B瓶的作用是对比.
[探究实验三]
| 实验步骤 | 实验现象 | 结论 |
| 取图2实验中A瓶反应后所得的溶液少许于试管中,再向试管中滴加稀盐酸溶液 | 有气泡产生 | 验证了二氧化碳和氢氧化钠溶液发生了反应 |
①可以借助酸碱指示剂证明反应的发生;
②通过检验生成物证明反应的发生.
15.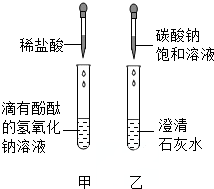 同学们在学碱的化学性质时,做了如图所示的甲、乙两个实验.
同学们在学碱的化学性质时,做了如图所示的甲、乙两个实验.
(1)写出甲实验的化学反应方程式HCl+NaOH=NaCl+H2O.
(2)实验结束后,甲、乙两个同学将废液倒入实验室的废液缸中,结果发现废液浑浊并呈红色,于是他们产生了疑问.
【提出问题】废液中含有哪些物质?
【交流讨论】①一定含有的物质:碳酸钙、指示剂、NaCl和水.
②还含有能使废液呈碱性的物质.能使废液呈碱性的物质是什么?同学们有如下猜想.
小刚认为:只有碳酸钠
小红认为:只有氢氧化钙
小林认为:是氢氧化钠和碳酸钠
你认为还可能是NaOH.(写一种猜想)
【设计实验】小芳想用氯化钙溶液来验证小刚、小红、小林的猜想.查阅资料得知氯化钙溶液呈中性,并设计如下实验.请你将小芳的实验设计补充完整.
【反思拓展】在分析化学反应后所得物质的成分时,除了考虑生成物外还需考虑反应物的用量.
 同学们在学碱的化学性质时,做了如图所示的甲、乙两个实验.
同学们在学碱的化学性质时,做了如图所示的甲、乙两个实验.(1)写出甲实验的化学反应方程式HCl+NaOH=NaCl+H2O.
(2)实验结束后,甲、乙两个同学将废液倒入实验室的废液缸中,结果发现废液浑浊并呈红色,于是他们产生了疑问.
【提出问题】废液中含有哪些物质?
【交流讨论】①一定含有的物质:碳酸钙、指示剂、NaCl和水.
②还含有能使废液呈碱性的物质.能使废液呈碱性的物质是什么?同学们有如下猜想.
小刚认为:只有碳酸钠
小红认为:只有氢氧化钙
小林认为:是氢氧化钠和碳酸钠
你认为还可能是NaOH.(写一种猜想)
【设计实验】小芳想用氯化钙溶液来验证小刚、小红、小林的猜想.查阅资料得知氯化钙溶液呈中性,并设计如下实验.请你将小芳的实验设计补充完整.
| 实验内容 | 预计现象 | 预计结论 |
| 取少量废液缸中上层清液于试管 中,加入过量氯化钙溶液,静置. | ①有白色沉淀,溶液呈红色. | 小林的猜想正确. |
| ②产生白色沉淀、溶液为无色. | 小刚的猜想正确. | |
| ③无白色沉淀,溶液呈红色. | 小红的猜想正确. |
12.下列图象能正确反映其对应关系的是( )
| A. |  向氢氧化钠溶液中不断加水,溶液pH与加入水的质量的关系 | |
| B. |  向盛有氧化铜的烧杯中加入稀盐酸至过量,生成氯化铜质量与加入稀盐酸质量的关系 | |
| C. |  一定量的稀硫酸与锌粒反应,溶液的质量与反应时间的关系 | |
| D. |  向盛有硫酸铜和硫酸溶液的烧杯中滴加氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的质量关系 |
 甲、乙两位同学做如下两个实验,请回答:
甲、乙两位同学做如下两个实验,请回答: 是硒离子(Se2-)的结构示意图.
是硒离子(Se2-)的结构示意图.
 铁锅、铝锅是生活中常用的炊具,如图是铁锅的示意图.
铁锅、铝锅是生活中常用的炊具,如图是铁锅的示意图.