题目内容
15.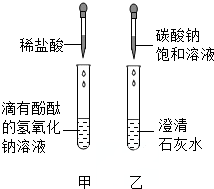 同学们在学碱的化学性质时,做了如图所示的甲、乙两个实验.
同学们在学碱的化学性质时,做了如图所示的甲、乙两个实验.(1)写出甲实验的化学反应方程式HCl+NaOH=NaCl+H2O.
(2)实验结束后,甲、乙两个同学将废液倒入实验室的废液缸中,结果发现废液浑浊并呈红色,于是他们产生了疑问.
【提出问题】废液中含有哪些物质?
【交流讨论】①一定含有的物质:碳酸钙、指示剂、NaCl和水.
②还含有能使废液呈碱性的物质.能使废液呈碱性的物质是什么?同学们有如下猜想.
小刚认为:只有碳酸钠
小红认为:只有氢氧化钙
小林认为:是氢氧化钠和碳酸钠
你认为还可能是NaOH.(写一种猜想)
【设计实验】小芳想用氯化钙溶液来验证小刚、小红、小林的猜想.查阅资料得知氯化钙溶液呈中性,并设计如下实验.请你将小芳的实验设计补充完整.
| 实验内容 | 预计现象 | 预计结论 |
| 取少量废液缸中上层清液于试管 中,加入过量氯化钙溶液,静置. | ①有白色沉淀,溶液呈红色. | 小林的猜想正确. |
| ②产生白色沉淀、溶液为无色. | 小刚的猜想正确. | |
| ③无白色沉淀,溶液呈红色. | 小红的猜想正确. |
分析 (1)根据氢氧化钠与盐酸的反应写出化学方程式;
(2)[交流讨论]①根据上述反应及稀盐酸与氢氧化钠反应,碳酸钠与氢氧化钙的反应分析废液中一定含有的物质;
②根据题意含有能使废液呈碱性的物质和反应物的量,分析呈碱性的物质;
[实验设计]根据氯化钙的性质分析设计实验.
[反思拓展]在分析化学反应后所得物质的成分时,除了考虑生成物外还需考虑反应物的量.
解答 解:(1)在甲实验中氢氧化钠与盐酸的反应生成了氯化钠和水,反应的化学反应方程式是:HCl+NaOH=NaCl+H2O;
(2)①由于稀盐酸与氢氧化钠反应生成了氯化钠和水,碳酸钠与氢氧化钙反应生成了碳酸钙沉淀和氢氧化钠.所以,一定含有的物质一定有碳酸钙、指示剂、水、NaCl;
②由题意可知,含有能使废液呈碱性的物质,根据反应物的量和生成物的性质可知,还可能是NaOH;
[实验设计]取少量废液缸中上层清液于试管中,加入过量氯化钙溶液,静置.如果有白色沉淀,溶液呈红色.则显碱性的物质是氢氧化钠和碳酸钠,小林的猜想正确;如果产生白色沉淀、溶液为无色,则显碱性的物质只有碳酸钠,小云的猜想正确;如果无白色沉淀,溶液呈红色,则显碱性的物质是氢氧化钠和碳酸钠,小红的猜想正确.所以:
| 实验内容 | 预计现象 | 预计结论 |
| 小林 | ||
| ②产生白色沉淀、溶液为无色. | ||
| 小红 |
故答为:(1)HCl+NaOH=NaCl+H2O;[交流讨论]①水;②NaOH或NaOH;[实验设计]见上表,[反思拓展]反应物的量.
点评 本题属于实验探究题,还有化学方程式的书写,综合性比较强.有关实验方案的设计是中考的热点之一,本题根据题目提供的信息,结合实验探究的一般步骤和酸碱盐的性质等知识来解决,还要注意化学方程式的书写和配平.本考点主要出现在实验题中.

练习册系列答案
相关题目
20.如表是Ca(OH)2和NaOH的溶解度数据.请回答下列问题:
(1)依据表中数据,溶解度曲线随温度的升高而降低的是Ca(OH)2.
(2)20℃时,NaOH的溶解度为91g.
(3)要想把一瓶接近饱和的Ca(OH)2溶液变成饱和溶液,具体的措施有:①加入氢氧化钙,②升高温度,③减低温度,④加入水,⑤蒸发水后再恢复到原温度,⑥加入生石灰.其中正确的是D.
A.②④⑥B.③④C.①③⑤⑥D.①②⑤⑥
(4)现将20℃时Ca(OH)2的饱和溶液甲溶液降温至0℃得到乙溶液,则两种溶液中溶质的质量分数相比,乙=(填“>”“<”或“=”)甲.
(5)现有60℃时含Ca(OH)2和NaOH两种溶质的饱和溶液,若要得到较纯净的NaOH晶体,应采取的物理方法是降温结晶并过滤.
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度/g | Ca(OH)2 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 |
| NaOH | 31 | 91 | 111 | 129 | 313 | 336 | |
(2)20℃时,NaOH的溶解度为91g.
(3)要想把一瓶接近饱和的Ca(OH)2溶液变成饱和溶液,具体的措施有:①加入氢氧化钙,②升高温度,③减低温度,④加入水,⑤蒸发水后再恢复到原温度,⑥加入生石灰.其中正确的是D.
A.②④⑥B.③④C.①③⑤⑥D.①②⑤⑥
(4)现将20℃时Ca(OH)2的饱和溶液甲溶液降温至0℃得到乙溶液,则两种溶液中溶质的质量分数相比,乙=(填“>”“<”或“=”)甲.
(5)现有60℃时含Ca(OH)2和NaOH两种溶质的饱和溶液,若要得到较纯净的NaOH晶体,应采取的物理方法是降温结晶并过滤.
5.下列除去混合物中少量杂质的方法或加入试剂合理的是( )
| 选项 | 物质 | 所含杂质 | 除去杂质的方法或加入试剂 |
| A | CuSO4溶液 | H2SO4 | 加入过量铜粉充分反应后过滤 |
| B | CuO | Cu | 在空气中灼烧 |
| C | NaOH溶液 | Na2CO3 | 加入稀盐酸至不再产生气泡 |
| D | CaO | CaCO3 | 加入足量蒸馏水,过滤 |
| A. | A | B. | B | C. | C | D. | D |
 图中,A、B、C、D、E、F、G是初中化学常见的物质,其中A、F为单质,B为氧化物,C是大理石的主要成分,D、E、G属于不同类别的物质,G由两种元素组成.“-”表示两端的物质能发生反应,“→”表示一种物质可转化为另一种物质.
图中,A、B、C、D、E、F、G是初中化学常见的物质,其中A、F为单质,B为氧化物,C是大理石的主要成分,D、E、G属于不同类别的物质,G由两种元素组成.“-”表示两端的物质能发生反应,“→”表示一种物质可转化为另一种物质.