题目内容
8.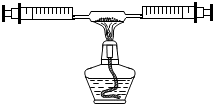 某课外活动小组在学习了书本“空气中氧气含量的测定”实验,知道P2O5不能随便排放在空气中,否则会对空气造成污染,所以对该实验进行了改进:
某课外活动小组在学习了书本“空气中氧气含量的测定”实验,知道P2O5不能随便排放在空气中,否则会对空气造成污染,所以对该实验进行了改进:在由两个注射器组成的密闭系统内共有50mL空气,如图.然后给装有红磷的玻璃管加热.同时交替推动两个注射器的活塞,至玻璃管内的红磷变成白烟,且较长时间内无进一步变化时停止.停止加热后,待冷却至室温将气体全部推至一个注射器内.
请根据你对上述实验的理解,回答下列问题:
(1)实验结束后,注射器内的气体体积理论上应该减少约10 mL.
(2)在实验的加热过程中,交替缓慢推动两个注射器的目的是使注射器内的氧气充分与红磷反应.写出该反应的符号表达式4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5.
(3)小明测得实验结果如下:
| 反应前注射器内气体总体积 | 反应后注射器内气体总体积 |
| 50mL | 42mL |
(4)上述实验只是粗略测定空气中氧气含量的一种方法,你认为造成该实验不够精确的可能原因是装置漏气.(填一种)
分析 (1)根据氧气约占空气体积的$\frac{1}{5}$解答;
(2)由实验条件可推出交替缓慢推动两个注射器的目的是使封闭空间的氧气充分反应.
(2)根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤进行书写;
(3)根据反应前后注射器内气体的体积变化,以及测定空气中氧气含量的注意事项回答;
(4)根据上面的实验可知,测量混合物中某成分含量的方法是利用化学反应除去混合物中的一种成分,再测量混合物在反应前后体积或质量的变化,从而得出该成分的含量进行解答.
解答 解:(1)氧气约占空气体积的$\frac{1}{5}$,实验结束后,注射器内的气体体积理论上应该减少约50mL×$\frac{1}{5}$=10mL;
(2)交替缓慢推动两个注射器的目的是使封闭空间的氧气与铜丝充分接触,使空气中的氧气与铜丝充分反应;红磷在空气中燃烧生成五氧化二磷,反应的化学方程式为:4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5;
(3)反应前注射器内气体的体积为50mL,反应后注射器内气体的体积为42mL,则氧气的体积为8mL,则空气中氧气的体积分数为$\frac{8mL}{50mL}$×100%=16%;
(4)造成该实验出现误差的原因可能是::①在加热过程中没有推拉注射器、②读数时没有冷却至室温、③加入红磷量太少、④装置漏气.
答案:
(1)10;
(2)使注射器内的氧气充分与红磷反应. 4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5;
(3)16%;
(4)装置漏气.
点评 空气是人类宝贵的自然资源,在中考中占有重要的地位,特别是空气中氧气含量的测定,要注意测定原理、实验关键、现象和结论、装置的评价和改进等内容的考查.

| A. | 加入盐酸 | B. | 滴加氢氧化钠浓溶液 | ||
| C. | 点燃 | D. | 加酒精 |
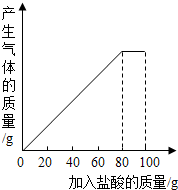 有一种石灰石样品的成分是CaCO3和SiO2.课外小组同学将100g盐酸分5次加入到35g石灰石样品中(已知SiO2不与盐酸反应,也不溶于水),得到如下部分数据和图象.
有一种石灰石样品的成分是CaCO3和SiO2.课外小组同学将100g盐酸分5次加入到35g石灰石样品中(已知SiO2不与盐酸反应,也不溶于水),得到如下部分数据和图象.| 次数 | 第1次 | 第2次 | 第3次 |
| 加入盐酸的质量/g | 20 | 20 | 20 |
| 剩余固体的质量/g | 30 | a | 20 |
(1)第2次加入盐酸后,a为25g.
(2)石灰石样品中钙元素、碳元素和氧元素的质量比为多少?10:3:22.
(3)求所用盐酸的质量分数?
| 污染物 | 指标/10-6gm-3 | 污染物 | 指标/10-6gm-3 | |
| 二氧化硫 | 5-400 | 二氧化氮 | 10-150 | |
| 一氧化碳 | 500-700 | 铅 | 0.01-2 |
(2)每个成年人在没被污染的空气中,每天吸入氧气的体积约为2.9或2.8立方米(精确到0.1).
