题目内容
16.有A、B、C、D四种元素,A是地壳中含量最多的金属元素,B元素原子第三电子层比第二电子层少一个电子,C元素的原子得到2个电子以及D元素原子失去一个电子后形成的离子均与氖原子具有相同的电子层结构.请回答下列问题:(1)写出上述三种元素的元素符号:AAl、BCl、CO、DNa.
(2)画出B原子和C离子的结构示意图.
B原子
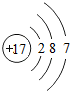 ;C离子
;C离子 .
.
分析 根据A、B、C、D四种元素,A是地壳中含量最多的金属元素,所以A是铝元素,B元素原子第三电子层比第二电子层少一个电子,第三层有7个电子,核外电子数是17个,所以B是氯元素,C元素的原子得到2个电子以及D元素原子失去一个电子后形成的离子均与氖原子具有相同的电子层结构,氖原子的核外电子数是10个,所以C是氧元素,D是钠元素,然后将推出的元素进行验证即可.
解答 解:(1)A、B、C、D四种元素,A是地壳中含量最多的金属元素,所以A是铝元素,B元素原子第三电子层比第二电子层少一个电子,第三层有7个电子,核外电子数是17个,所以B是氯元素,C元素的原子得到2个电子以及D元素原子失去一个电子后形成的离子均与氖原子具有相同的电子层结构,氖原子的核外电子数是10个,所以C是氧元素,D是钠元素,经过验证,推导正确,所以A是Al,B是Cl,C是O,D是Na;
(2)B原子和C离子的结构示意图为: ,
, .
.
故答案为:(1)Al,Cl,O,Na;
(2) ,
, .
.
点评 在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可.

练习册系列答案
相关题目
19.下列活动中,不是通过化学反应提供能量的是( )
| A. | 水力发电 | B. | 发射航天飞机 | ||
| C. | 汽油燃烧驱动汽车 | D. | 果蔬电池放电 |
7.下列实验操作中,不能达到实验目的是( )
| 选项 | 物质 | 实验目的 | 主要实验操作 |
| A | NaCl(杂质Na2CO3) | 除杂 | 加入适量稀硫酸,充分反应后,蒸发 |
| B | MnO2、KCl | 分离 | 溶解、过滤、洗涤干燥;蒸发结晶 |
| C | NH3(H2O) | 干燥 | 将气体通过装有浓硫酸的干燥装置 |
| D | NaOH、Ca(OH)2 | 鉴别 | 分别加入Na2CO3溶液,观察溶液的变化 |
| A. | A | B. | B | C. | C | D. | D |
4.某化学兴趣小组围绕“酸碱中和反应”,在老师引导下开展探究活动.
探究:证明氢氧化钠溶液与稀盐酸确实能发生反应.
【方案1】测定稀盐酸与NaOH溶液混合前后的pH.
测定某NaOH溶液的pH,pH大于7.将一定量的稀盐酸加入该NaOH溶液中,混合均匀后测定其pH,发现pH减小了,但仍然大于7,小组中有的同学认为根据这个测定结果不可以认为稀盐酸与NaOH溶液发生了反应,你认为他的理由氢氧化钠溶液中加水稀释pH也会减小.经过讨论后,他们向溶液中又加入一定量的稀盐酸,混合均匀后测定其pH,pH小于7.
结论:稀盐酸与氢氧化钠溶液发生了化学反应,并且稀盐酸过量.
【方案2】借助于无色酚酞试液.
【药品仪器】

①取A(选填“A”或“B”)中试剂加入至D中,滴加2滴酚酞试液,溶液呈红色;
②用胶头滴管向①中溶液滴加稀盐酸,红色消失;
③用F蘸取②中溶液,在酒精灯上灼烧,有白色固体产生.
【思考拓展】
(1)如不使用酸碱指示剂,进一步确认步骤③中的白色固体不是氢氧化钠的方法是:取少量白色固体将其溶解,加入CuSO4溶液,无蓝色沉淀生成;
(2)探究步骤②中无色溶液中稀盐酸是否过量.
根据上述反应过程中溶液变成无色,不能确定稀盐酸是否过量,兴趣小组同学又分别选
取了AgNO3溶液、紫色石蕊试液、铁锈粉末设计实验方案,请你分析并判断:
方案③中反应的化学方程式Fe2O3+6HCl═2FeCl3+3H2O.上述设计方案中,不正确的是①(填“①”、“②”或“③”),错误的原因是反应生成的NaCl也能与AgNO3反应生成白色沉淀;
(3)碱与酸反应不一定都无明显现象,写出一个有沉淀生成的中和反应:Ba(OH)2+H2SO4═BaSO4↓+2H2O.
探究:证明氢氧化钠溶液与稀盐酸确实能发生反应.
【方案1】测定稀盐酸与NaOH溶液混合前后的pH.
测定某NaOH溶液的pH,pH大于7.将一定量的稀盐酸加入该NaOH溶液中,混合均匀后测定其pH,发现pH减小了,但仍然大于7,小组中有的同学认为根据这个测定结果不可以认为稀盐酸与NaOH溶液发生了反应,你认为他的理由氢氧化钠溶液中加水稀释pH也会减小.经过讨论后,他们向溶液中又加入一定量的稀盐酸,混合均匀后测定其pH,pH小于7.
结论:稀盐酸与氢氧化钠溶液发生了化学反应,并且稀盐酸过量.
【方案2】借助于无色酚酞试液.
【药品仪器】

①取A(选填“A”或“B”)中试剂加入至D中,滴加2滴酚酞试液,溶液呈红色;
②用胶头滴管向①中溶液滴加稀盐酸,红色消失;
③用F蘸取②中溶液,在酒精灯上灼烧,有白色固体产生.
【思考拓展】
(1)如不使用酸碱指示剂,进一步确认步骤③中的白色固体不是氢氧化钠的方法是:取少量白色固体将其溶解,加入CuSO4溶液,无蓝色沉淀生成;
(2)探究步骤②中无色溶液中稀盐酸是否过量.
根据上述反应过程中溶液变成无色,不能确定稀盐酸是否过量,兴趣小组同学又分别选
取了AgNO3溶液、紫色石蕊试液、铁锈粉末设计实验方案,请你分析并判断:
| 实验方案 | 实验步骤 | 现象 | 结论 |
| ① | 取样,加入适量的AgNO3溶液 | 出现白色沉淀 | 稀盐酸过量 |
| ② | 取样,加入几滴紫色石蕊试液 | 溶液变红 | 稀盐酸过量 |
| ③ | 取样,加入铁锈粉末 | 溶液变黄色 | 稀盐酸过量 |
(3)碱与酸反应不一定都无明显现象,写出一个有沉淀生成的中和反应:Ba(OH)2+H2SO4═BaSO4↓+2H2O.
1.除去下列各物质中混有的少量杂质,所用除杂试剂及操作方法均正确的是( )
| 选项 | 物 质 | 杂 质 | 除杂试剂及操作方法 |
| A | 二氧化碳 | 一氧化碳 | 通入氧气,点燃 |
| B | 氢气 | 氯化氢 | 先通过过量氢氧化钠溶液,再通过浓硫酸 |
| C | 锌粉 | 铁粉 | 加入适量氯化锌溶液,充分反应后过滤 |
| D | 氯化钾溶液 | 碳酸钾 | 加入过量氯化钙溶液,充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |
5.同种元素组成的不同单质互称为同素异形体,例如白磷和红磷.下列各组物质互为同素异形体是( )
| A. | 一氧化碳和二氧化碳 | B. | 金刚石和石墨 | ||
| C. | 冰和干冰 | D. | 水和过氧化氢 |
6.某有机物6.0g在空气中完全燃烧,共得到8.8g二氧化碳和3.6g水,则该化合物的组成元素是( )
| A. | 该物质由碳、氢、氧三种元素组成 | |
| B. | 该物质只含有碳、氢两种元素 | |
| C. | 一定含有碳、氢元素,可能含有氧元素 | |
| D. | 该物质的分子中碳原子和氢原子的个数比为1:2 |
