题目内容
乙炔(C2H2)是生产聚氯乙烯的重要原料.用电石(主要成分为CaC2)与水反应可制取乙炔,最终还可得到电石渣.某电石渣中含氢氧化钙92.5%,其余为杂质,此电石渣可用于处理电镀厂排出的酸性废水.
(1)乙炔中碳、氢元素的质量比为 .
(2)100kg上述电石渣中氢氧化钙的质量为 kg.
(3)用上述电石渣处理含硫酸196 kg的酸性废水(假设电石渣中的杂质、废水中其他成分均不参加反应),求至少需要电石渣的质量(写出计算过程及结果).
考点:
根据化学反应方程式的计算;元素质量比的计算.
专题:
有关化学方程式的计算.
分析:
(1)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.
(2)根据题意,某电石渣中含氢氧化钙92.5%,其余为杂质,由电石渣的质量,计算出电石渣中氢氧化钙的质量即可.
(3)由酸性废水中硫酸的质量,根据反应的化学方程式计算出至少需要电石渣的质量即可.
解答:
解:(1)乙炔中碳、氢元素的质量比为(12×2):(1×6)=12:1.
(2)100kg上述电石渣中氢氧化钙的质量为100kg×92.5%=92.5kg.
(3)设至少需要电石渣的质量为x
Ca(OH)2+H2SO4═CaSO4+2H2O
74 98
x 92.5%x
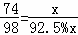 x=160kg
x=160kg
答:需要电石渣160kg.
点评:
本题难度不大,掌握根据化学方程式的计算、化学式的有关计算即可正确解答本题,解题时要注意解题的规范性.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列有关化肥和农药的说法错误的是( )
|
| A. | 氯化钾可用作钾肥 |
|
| B. | 化肥能有效提高农作物产量 |
|
| C. | 农药施用后,不会通过农作物转移到人体 |
|
| D. | 农药应根据农作物、虫害和农药的特点合理施用 |

 的质量变化,测算氧化铁样品中含有Fe2O3的质量分数。试验中,在其他操作正常的条件下,若下列情况出现,请你对测算出的结果与实际值相比较,并作出判断(用“偏小”“偏大”“不受影响”之一填写下列空白)。
的质量变化,测算氧化铁样品中含有Fe2O3的质量分数。试验中,在其他操作正常的条件下,若下列情况出现,请你对测算出的结果与实际值相比较,并作出判断(用“偏小”“偏大”“不受影响”之一填写下列空白)。
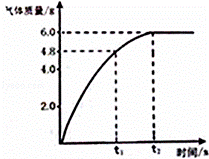
 化钠溶液
化钠溶液