题目内容
为测定某Cu﹣Zn合金中铜的质量分数,某同学将10g该合金放入到盛有40g足量稀硫酸的烧杯中,充分反应后,测得烧杯中剩余物的质量为49.9g.
(1)生成氢气的质量为 ;
(2)计算原合金中铜的质量分数.
考点:
根据化学反应方程式的计算.
专题:
有关化学方程式的计算.
分析:
根据黄铜的成分铜和锌的性质可知,加入稀硫酸时,只有锌与硫酸反应生成了硫酸锌和氢气;根据质量守恒定律,烧杯内质量的减少的质量即生成的氢气质量,据此根据反应的化学方程式列式计算出参加反应锌的质量,进而计算出铜的质量和铜的质量分数.
解答:
解:
(1)根据质量守恒定律,产生氢气的质量为:10g+40g﹣49.9g=0.1g;
(2)设黄铜样品中锌的质量为x,
Zn+H2SO4═ZnSO4+H2↑
65 2
x 0.1g
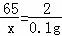
x=6.5g
黄铜样品中铜的质量分数为: ×100%=35%
×100%=35%
答案:
(1)0.1g;
(2)黄铜样品中铜的质量分数为35%.
点评:
本题难度不大,掌握根据化学方程式的计算即可正确解答本题,根据质量守恒定律计算出氢气的质量是正确解答本题的前提和关键.

 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案马英同学取某地石灰石样品12g进行测定实验,现将100g稀盐酸分五次加入石灰石样品中(杂质不溶于水也不参与反应),充分反应后测得生成气体的总质量如表所示:
| 第1次 | 第2次 | 第3次 | 第4次 | 第5次 | |
| 加入稀盐酸的质量/g | 20 | 20 | 20 | 20 | 20 |
| 生成气体的总质量/g | 1.1 | 2.2 | m | 4.4 | 4.4 |
试求:
(1)m的值为 g.
(2)12g石灰石样品中碳酸钙的质量等于 g.
(3)反应完全后最终溶液中氯化钙的质量分数? .
(写出计算过程,计算结果精确至0.1)
尿素[CO(NH2)2]是一种常见的化学肥料,它属于( )
|
| A. | 钾肥 | B. | 磷肥 | C. | 氮肥 | D. | 农家肥 |


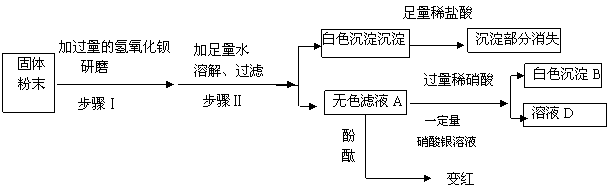
 能由NH4Cl、 Na2CO3 、NaCl 、NaOH 、Na2SO4中的一种或几种组成。为了确定其组成,某化学兴趣小组做了以下实验:
能由NH4Cl、 Na2CO3 、NaCl 、NaOH 、Na2SO4中的一种或几种组成。为了确定其组成,某化学兴趣小组做了以下实验: