题目内容
3.烧碱的用途很广,工业上制得的烧碱中常含有杂质碳酸钠,某化学兴趣小组同学对购买的烧碱成分和纯度测定展开了讨论与探究.(1)为检验烧碱中是否含有碳酸钠,同学们提出不同方案.
方案一:配成溶液,向其中滴加酚酞试液.同学们认为该方法无法检验,原因是两种溶液都呈碱性.
方案二,配成溶液,向其中慢慢滴加稀盐酸,大家发现,刚开始滴加时无气泡产生,原因是NaOH+HCl=NaCl+H2O (用化学方程式表示).
方案三:配成溶液,向其中滴加一种盐的溶液,可以证明含有碳酸钠,该溶液是BaCl2、(或CaCl2、Ca(NO3)2等).
(2)测定烧碱的纯度
实验原理:利用Na2CO3与稀H2SO4反应产生CO2,通过测定CO2的质量,确定样品中碳酸钠的质量,从而计算样品的纯度.
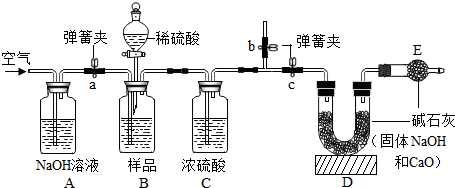
①学们根据实验原理,设计了如图的实验(固定装置省略),装置A的作用是除去空气中的CO2.
②B装置中样品在与稀硫酸反应前和停止反应后,都要通入过量的空气.反应前通空气的目的是排出装置中的CO2.停止反应后,若不再通入空气,则测得工业烧碱的纯度将偏高(填“偏高”“偏低”或“无影响”).
③若撤去C装置,则测得工业烧碱的纯度将偏低(填“偏高”“偏低”或“无影响”).
④D、E中都放入碱石灰,其中,E中碱石灰的作用是防止空气中的水和二氧化碳进入D装置.
⑤现取50克样品,按照图中正确的实验方法测定,待无气泡产生时,称得C装置增重0.6克,D装置增重2.2克,试通过计算,推测样品中烧碱的纯度?(有计算过程,精确到0.1%)
⑥反思:若用上面的烧碱配制氢氧化钠溶液,需除去其中的碳酸钠,除去的方法很多,比如,向该样品配制的溶液中加入适量Ca(OH)2 溶液,过滤,即得到氢氧化钠溶液.
分析 (1)方案一:根据氢氧化钠和碳酸钠溶液都呈碱性进行解答;
方案二:根据盐酸要先与氢氧化钠反应进行解答;
方案三:根据碳酸钠能和氯化钡溶液、氯化钙溶液、硝酸钙溶液等反应产生白色沉淀进行解答;
(2)①根据空气中含有二氧化碳,氢氧化钠溶液能吸收二氧化碳进行解答;
②根据通入空气的目的是排出装置中的CO2进行解答;
③根据浓硫酸具有吸水性,能除去二氧化碳气体中的水蒸气进行解答;
④根据E中碱石灰的作用是防止空气中的水和二氧化碳进入D装置进行解答;
⑤根据D装置增重2.2克是生成二氧化碳的质量进行解答;
⑥根据氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠进行解答.
解答 解:(1)方案一:氢氧化钠和碳酸钠溶液都呈碱性,所以不能用酚酞试液检验是否含有碳酸钠;故填:两种溶液都呈碱性;
方案二:盐酸要先与氢氧化钠反应生成氯化钠和水,所以配成溶液,向其中慢慢滴加稀盐酸,大家发现刚开始滴加时无气泡产生,化学方程式为NaOH+HCl=NaCl+H2O;故填:NaOH+HCl=NaCl+H2O;
方案三:碳酸钠能和氯化钡溶液、氯化钙溶液、硝酸钙溶液等反应产生白色沉淀,所以配成溶液,向其中滴加BaCl2、CaCl2、Ca(NO3)2 等的溶液,可以证明含有碳酸钠;故填:BaCl2、(或CaCl2、Ca(NO3)2 等);
(2)①空气中含有二氧化碳,氢氧化钠溶液能吸收二氧化碳,所以装置A的作用是除去空气中的CO2;故填:除去空气中的CO2;
②通入空气的目的是排出装置中的CO2;若不再通入空气,装置中有剩余二氧化碳,使得计算出的碳酸钠的质量较小,则测得工业烧碱的纯度将偏高;故填:排出装置中的CO2;偏高;
③浓硫酸具有吸水性,能除去二氧化碳气体中的水蒸气,所以若撤去C装置,使得计算出的碳酸钠的质量偏大,则测得工业烧碱的纯度将偏低;故填:偏低;
④E中碱石灰的作用是防止空气中的水和二氧化碳进入D装置;故填:防止空气中的水和二氧化碳进入D装置;
⑤设碳酸钠的质量为x
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
106 44
x 2.2g
$\frac{106}{x}=\frac{44}{2.2g}$
x=5.3g
样品中烧碱的纯度=$\frac{50g-5.3g}{50g}×100%$=89.4%
答:样品中烧碱的纯度为89.4%
⑥氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,所以可用氢氧化钙溶液除去碳酸钠.故填:Ca(OH)2.
点评 解答这类题目时,首先,赏析问题情景,找到实验探究的反应原理,弄清个装置的作用;再根据实验的反应原理,分析推断出该物质的组成成分,然后得出所要探究的物质中该成分的组成.

 53天天练系列答案
53天天练系列答案 如果将物质按单质、氧化物、酸、碱、盐、有机物分类,如图中甲、乙、丙是三种不同类别的物质,且相连物之间均能发生化学反应,下列说法符合图示要求的是( )
如果将物质按单质、氧化物、酸、碱、盐、有机物分类,如图中甲、乙、丙是三种不同类别的物质,且相连物之间均能发生化学反应,下列说法符合图示要求的是( )| A. | 当甲、乙、丙分别为酸、碱、盐时,X一定不可能为碳酸钠 | |
| B. | 当X为氧气时,甲、乙、丙可以为镁、红磷、葡萄糖 | |
| C. | 当X为稀盐酸时,甲、乙、丙可以为铜、氢氧化铜、硝酸银 | |
| D. | 当甲为氯化铵时、乙为硫酸时,丙为氧化铝时,X可以为氢氧化钠 |
| A. |  检查装置气密性 | B. |  氧气验满 | C. |  稀释浓硫酸 | D. |  量9.5mL液体 |
| A. | 稀盐酸 氯化钠溶液 碳酸钠溶液 硝酸钾溶液 | |
| B. | 稀硫酸 稀盐酸 酚酞试液 氢氧化钠溶液 | |
| C. | 稀盐酸 酚酞试液 碳酸钠溶液 氢氧化钠溶液 | |
| D. | 稀盐酸 石灰水 硝酸钡溶液 碳酸钠溶液 |
| A. | 正常雨水的pH 约为5.6是因为CO2+H2O=H2CO3 | |
| B. | 医疗上用含有Mg(OH)2的药剂治疗胃酸过多的病症:Mg(OH)2+2HCl═MgCl2+2H2O | |
| C. | 用稀盐酸除铁锈:Fe2O3+6HCl═2FeCl3+3H2O | |
| D. | 用稀盐酸除去试管壁上残留的铜:2HCl+Cu=CuCl2+H2 |
| A. | 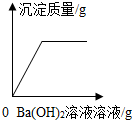 向H2SO4和CuSO4的混合溶液中滴加Ba(OH)2溶液 | |
| B. | 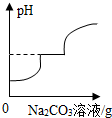 向HCl和CaCl2混合溶液中滴加Na2CO3溶液 | |
| C. | 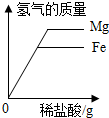 向等质量的Mg和Fe中滴加稀盐酸 | |
| D. | 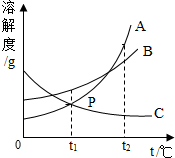 将t2℃时A、B、C的饱和溶液降温至t1℃时,其溶质质量分数大小关系为B>A=C |
| A. | 糖水 | B. | 泥水 | C. | 白酒 | D. | 汽水 |