题目内容
12.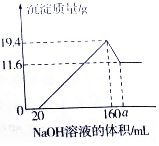 已知:Mg(OH)2是难溶性碱,不溶于碱性溶液;A1(OH)3也是难溶性碱,但它既可以与强酸反应,生成可溶性铝盐,也可以与强碱反应,生成可溶性偏铝酸盐,例如Al(OH)3+NaOH=NaAlO2(偏铝酸钠)+2H2O.现将一定质量的镁铝合金样品全部溶于100mL某浓度的盐酸溶液中,之后向所得溶液中滴加200g/L的NaOH溶液,生成沉淀质量与加入的NaOH溶液体积关系如图所示.
已知:Mg(OH)2是难溶性碱,不溶于碱性溶液;A1(OH)3也是难溶性碱,但它既可以与强酸反应,生成可溶性铝盐,也可以与强碱反应,生成可溶性偏铝酸盐,例如Al(OH)3+NaOH=NaAlO2(偏铝酸钠)+2H2O.现将一定质量的镁铝合金样品全部溶于100mL某浓度的盐酸溶液中,之后向所得溶液中滴加200g/L的NaOH溶液,生成沉淀质量与加入的NaOH溶液体积关系如图所示.(1)生成的19.4g沉淀的化学式是Mg(OH)2和Al(OH)3;
(2)图中a=180;
(3)盐酸溶液溶质的质量是29.2g.
分析 由于在混合溶液中有镁离子和铝离子,所以加入氢氧化钠溶液至160mL时沉淀质量最大,此时是生成的氢氧化镁和氢氧化铝.由继续加入氢氧化钠溶液只有氢氧化铝反应,所以根据减少的固体的质量为氢氧化铝可以求算消耗的氢氧化钠溶液的体积.由于氯元素和钠元素守恒,可得100mL稀盐酸中的HCl的氯元素和氢氧化钠中的钠元素都进入了氯化钠,得关系式为HCl~~~NaCl~~~NaOH,求算100mL盐酸中的HCl的质量.
解答 解:
由于在混合溶液中有镁离子和铝离子,所以加入氢氧化钠溶液至160mL时沉淀质量最大,此时是生成的氢氧化镁和氢氧化铝,对应的化学式是Mg(OH)2和Al(OH)3;
根据图可以看出固体从最大量减少时,只减少了19.4g-11.6g=7.8g也就是氢氧化铝的质量为7.8g
设与氢氧化铝反应的氢氧化钠溶液的体积为x
Al(OH)3+NaOH=NaAlO2+2H2O
78 40
7.8g 200g/L x
$\frac{78}{40}$=$\frac{7.8g}{200g/Lx}$
x=0.02L=20mL
a=160+20=180
沉淀质量达到最大时,由于氯元素和钠元素守恒,可得100mL稀盐酸中的HCl的氯元素和氢氧化钠中的钠元素都进入了氯化钠,得关系式为HCl~~~NaCl~~~NaOH
由于至沉淀最大量时,消耗的氢氧化钠溶液只有160mL即为0.16L,其中溶质氢氧化钠的质量为200g/L×0.16L=32g
设稀盐酸中溶质HCl的质量为x
HCl~~~NaCl~~~NaOH
36.5 40
x 32g
$\frac{36.5}{40}$=$\frac{x}{32g}$
x=29.2g
答:(1)生成的19.4g沉淀的化学式是 Mg(OH)2和Al(OH)3;
(2)图中a=180;
(3)盐酸溶液溶质的质量是 29.2g.
点评 根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整.

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案| A. | Zn (NO3)2、AgNO3 | B. | Zn (NO3)2、Cu (NO3)2、AgNO3 | ||
| C. | Zn (NO3)2、Cu (NO3)2、 | D. | Zn (NO3)2 |
| A | B | C | D |
| E |
(2)A元素的单质有多种,其中能用于制作干电池电极的是石墨,制糖工业中利用活性炭的吸附性脱色制白糖.
(3)如图所示的是实验室制取O2常用的装置.实验室用H2O2制取O2的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,用该原理制取并收集O2时应选择的装置是BC或BD.

| A. | 反应①中,C是还原剂 | B. | 高纯硅是金属单质 | ||
| C. | ②③的目的是将粗硅提纯 | D. | ①②③都属于置换反应类型 |
| A. | 浸了汗水的衣服风干后有白色固体析出 | |
| B. | 蜡烛燃烧 | |
| C. | 铁矿石冶炼成铁 | |
| D. | 葡萄酿酒 |

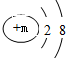 ,其微粒符号可表示为A2-,则m的值为8.
,其微粒符号可表示为A2-,则m的值为8. 能源和环境问题日益成为人们关注的焦点.
能源和环境问题日益成为人们关注的焦点.