题目内容
2.已知20℃时,KCl的溶解度为34克,50℃时的溶解度为42.6克.通过以下实验操作得到溶液①至⑤:
(1)上述实验所得溶液中,属于饱和溶液的是②④⑤;
(2)溶液①、④的质量分别为60、71.3g;
(3)溶液⑤中,溶质的质量分数为25.4%.
分析 根据固体的溶解度是指在一定温度下,某固体物质在100g水中达到饱和状态时所溶解的质量,根据固体物质的溶解度可以判断出在一定温度时形成的溶液是否饱和进行解答.
解答 解:由于氯化钾在20℃时的溶解度是34g,即100g水中最多溶解34g氯化钾,50g水中最多溶解17g氯化钾;因此在20℃时在50g水中加入10g氯化钾,氯化钾会全部溶解,得到的①溶液是20℃不饱和溶液;又加入10g氯化钾,由于在50g水中最多溶解17g氯化钾,因此这20g氯化钾只能溶解17g,所以形成的②溶液是20℃饱和溶液;升温至50℃,由于氯化钾在50℃时的溶解度是42.6g,50g水中最多溶解21.3g氯化钾,因此后加入的氯化钾会全部溶解,而且形成的溶液③是50℃不饱和溶液,但又加入10g氯化钾,这10g氯化钾会再溶解1.3g,形成的溶液④是50℃饱和溶液,然后降温到20℃时,有晶体析出,形成溶液⑤是20℃饱和溶液.
(1)上述实验所得溶液中,属于饱和溶液的是②④⑤;
(2)溶液①的质量=50g+10g=60g;溶液④的质量=50g+21.3g=71.3g;
(3)⑤是20℃饱和溶液,氯化钾在20℃时的溶解度是34g,即100g水中最多溶解34g氯化钾,50g水中最多溶解17g氯化钾;溶质的质量分数为$\frac{34g}{100g+34g}×100%$≈25.4%
故答案为:(1)②④⑤; (2)60;71.3; (3)25.4%
点评 解答本题关键是熟悉饱和溶液与不饱和溶液的转化,知道溶解度的四要素.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.如图是甲、乙、丙三种物质的溶解度曲线,下列说法正确的是( )


| A. | t1℃时,30g甲物质溶于70g水中得到30%的甲溶液 | |
| B. | t3℃时将甲、乙两物质的饱和溶液降温到t2℃,析出晶体质量甲>乙 | |
| C. | t2℃时,甲、丙溶液中溶质的质量分数甲>丙 | |
| D. | 将t3℃时甲、乙、丙三种物质的饱和溶液降温到t1℃,所得溶液溶质的质量分数关系是乙>甲>丙 |
10.目前使用的燃料大多来自化石燃料.
(1)写出天然气中甲烷完全燃烧的化学方程式CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O.
(2)分析下表,与煤相比,用天然气作燃料的优点有等质量的天然气和煤完全燃烧,天然气燃烧产生二氧化碳的质量少于煤,放出的热量多于煤.
(3)为提高煤的利用率,可将其转化为可燃性气体,该反应的微观示意图如下,则生成物的分子个数比为1:1.

(1)写出天然气中甲烷完全燃烧的化学方程式CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O.
(2)分析下表,与煤相比,用天然气作燃料的优点有等质量的天然气和煤完全燃烧,天然气燃烧产生二氧化碳的质量少于煤,放出的热量多于煤.
| 1g物质完全燃烧 | ||
| 产生二氧化碳的质量/g | 放出的热量/kJ | |
| 甲烷 | 2.75 | 56 |
| 煤碳 | 3.67 | 32 |

17.下列仪器的名称不正确的是( )
| A. |  酒精灯 | B. |  量筒 | C. |  试管 | D. |  长颈漏斗 |
7.镁、铝、铁等金属与我们生活息息相关
(1)用打磨好的镁条将五号干电池、小灯泡连接起来,灯泡发亮,这是利用镁的导电性.
(2)镁在空气中表面易被氧化,生成氧化镁(MgO),写出该反应的化学方程式2Mg+O2=2MgO.
(3)表中是镁、铝、铝镁合金的某些物理性质.可见,在铝中加入镁后,形成的铝镁合金在性能上发生了变化,其中之一是熔点降低(或硬度增大).
(4)钢铁制作的自行车车架表面喷漆可以防锈,其原理是隔绝氧气(或空气)和水.
| 金属 | 镁 | 铝 | 铝镁合金 |
| 熔点/℃ | 649 | 660 | 463 |
| 硬度 | 2.0 | 2.75 | 3-4 |
(2)镁在空气中表面易被氧化,生成氧化镁(MgO),写出该反应的化学方程式2Mg+O2=2MgO.
(3)表中是镁、铝、铝镁合金的某些物理性质.可见,在铝中加入镁后,形成的铝镁合金在性能上发生了变化,其中之一是熔点降低(或硬度增大).
(4)钢铁制作的自行车车架表面喷漆可以防锈,其原理是隔绝氧气(或空气)和水.
14.如图是甲、乙、丙三种物质的溶解度曲线,下列分析不正确的是( )


| A. | t2℃时,甲、乙、丙三种物质的溶解度由大到小的顺序是甲>乙>丙 | |
| B. | t2℃时,将50g甲物质放入100g水中充分溶解得到甲的饱和溶液 | |
| C. | 将t2℃时,三种物质的饱和溶液降温 至t1℃,所得溶液的溶质质量分数关 系是乙>甲=丙 | |
| D. | 将丙的饱和溶液变为不饱和溶液,可采用降温的方法 |

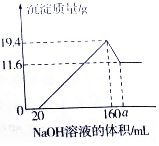 已知:Mg(OH)2是难溶性碱,不溶于碱性溶液;A1(OH)3也是难溶性碱,但它既可以与强酸反应,生成可溶性铝盐,也可以与强碱反应,生成可溶性偏铝酸盐,例如Al(OH)3+NaOH=NaAlO2(偏铝酸钠)+2H2O.现将一定质量的镁铝合金样品全部溶于100mL某浓度的盐酸溶液中,之后向所得溶液中滴加200g/L的NaOH溶液,生成沉淀质量与加入的NaOH溶液体积关系如图所示.
已知:Mg(OH)2是难溶性碱,不溶于碱性溶液;A1(OH)3也是难溶性碱,但它既可以与强酸反应,生成可溶性铝盐,也可以与强碱反应,生成可溶性偏铝酸盐,例如Al(OH)3+NaOH=NaAlO2(偏铝酸钠)+2H2O.现将一定质量的镁铝合金样品全部溶于100mL某浓度的盐酸溶液中,之后向所得溶液中滴加200g/L的NaOH溶液,生成沉淀质量与加入的NaOH溶液体积关系如图所示.